Клещевой энцефалит: Этиология. Эпидемиология и профилактика в Сибири
Характеристика вирусспецифических, белков
Материалы, изложенные в предыдущем разделе, свидетельствуют о том, что в процессе репродукции флавивирусов в клетке синтезируются три структурных и ряд неструктурных вирусспецифических белков. В табл. 4 приводится используемая в современной литературе и в работах прошлых лет номенклатура флавивирусспецифических полипептидов.
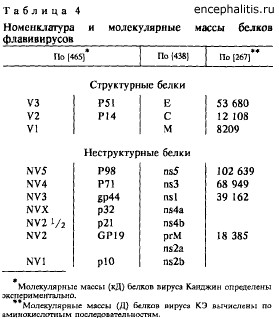
В результате репродукции флавивирусов во внеклеточное пространство секретируется четыре вирусспецифических белка: структурные белки С, М и Е, которые идентифицируются в очищенных вирионах, и неструктурный белок NS1. Последний в гликозилированной форме определяется как растворимый комплементсвязывающий антиген [421].
Гликопротеин Е (от англ. envelope) входит в состав суперкапсидной оболочки флавивирусов, белок С (core) вместе с РНК формирует нуклеокапсид, а мембранный белок М (membrane), по-видимому, локализован в области внутренней мембраны суперкапсидной оболочки. Суммарно структурные белки Е, С и М составляют 66 % массы вириона. Белок Е является основным функциональным белком оболочки и содержит штаммоспецифические, подтипоспецифические, типоспецифические, комплексреактивные и группореактивные антигенные детерминанты. Гликопротеин Е участвует в различных серологических реакциях, а также стимулирует синтез вируснейтрализующих антител и антигемагглютининов при иммунизации животных. Полагают, что значение сердцевинного белка С и мембранного белка М в стимуляции защитных антител невелико или отсутствует вовсе. М.П. Чумаков и др. [349, 350] показали, что в результате обработки вирионов вируса КЭ детергентами тритон Х-100, ЦТАБ или октил-В-(1-глюкопиранозид и последующего центрифугирования в градиенте плотности сахарозы (ГПС) гликопротеин Е можно отделить от нуклеокапсида и получить в виде не содержащих липидов полимерных "розеток" строго определенных физических свойств. Гликопротеины по антигенной активности не отличались от этих же белков в составе вириона или превышали ее. Препараты "розеток" обладали протективной активностью, сопоставимой с цельным аттенуированным вирусом клещевого энцефалита.
Важная и принципиально новая информация о структурно-функциональной организации гликопротеина Е вируса клещевого энцефалита получена с помощью моноклональных антител (МкАт). F. Heinz и др. [408—411] иммунизировали двухмесячных мышей Balb/C очищенными гликопротеидными комплексами оболочки вируса КЭ и гибридизовали клетки селезенок этих мышей с клетками миеломы Х63—Ag8/653. В результате селекции гибридных клонов получено 12 культур, обладающих устойчивым ростом и способностью продуцировать специфические моноклональные антитела.
С целью построения топологической и функциональной модели гликопротеина Е использовали 10 штаммов вируса клещевого энцефалита, изолированных на протяжении 26 лет в Западной и Центральной Европе от человека, лошади, клещей, а также восточный вариант вируса, штамм Софьин, вирус ШЭО (комплекс вирусов КЭ) и флавивирусы лихорадки ЗН и энцефалита Долины Мюррея. Реактивность восьми МкАт с вирусным гликопротеином Е характеризовали с помощью иммуноферментного анализа (ИФА), реакции торможения гемагглютинации (РТГА), реакции нейтрализации (РН), пассивной защиты мышей от летальной вирусной инфекции и по конкурентному блокированию антител. В результате изучения специфичности и пространственных взаимоотношений МкАт на поверхности гликопротеина Е выявлено восемь эпитопов, семь из которых формировали две области антигенно активных доменов А и В, а восьмой находился за пределами доменов. В последующем этими же авторами [427], а также А.С. Каравановым и др. [134] обнаружено три антигенных домена на поверхности гликопротеина Е. На рис. 3 показана локализация детерминант различной специфичности на белке оболочки вируса КЭ. Домен А содержал эпитопы как с широким спектром специфичности на уровне перекрестной реактивности с флавивирусами, так и подтипоспецифические. Большая часть эпитопов домена В определена как комплексреактивная, в то время как домен С включал преимущественно подтипоспецифические эпитопы.
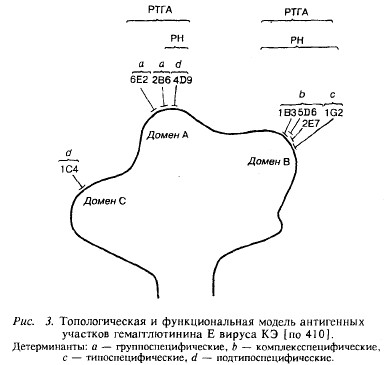
Как уже упоминалось, отмечена диссоциация функциональной активности гликопротеина Е на уровне эпитопов. Авторами, а также J. Stephenson и др. [453] показано, что гемагглютинирующая и нейтрализующая активности вируса КЭ могут быть топологически разделены. В дальнейшем [415] с использованием семи различных антигенных вариантов вируса КЭ, селекционированных в присутствии МкАт, установлена точная локализация эпитопов в аминокислотной последовательности белка Е, а также продемонстрирована его архитектура с помощью метода кристаллографии [437].
Для характеристики физико-химических свойств, структуры, а также механизмов биосинтеза вирусных белков большое значение имеют данные исследования особенностей их электрофоретического поведения. В результате анализа методом электрофореза в полиакриламидном геле (ПААГ) полипептидов различных изолятов вируса КЭ [473] выявлено, что подвижность белков Е и С всех изученных штаммов одинакова, их молекулярные массы (м.м.) составляют соответственно 55 и 15 кД. Что касается полипептида М, то обнаружена вариабельность м.м. этого белка от 6,5 до 7,5 кД. Однако в более поздней работе [405] описан штамм вируса КЭ ZZ-9, С-белок которого мигрирует в геле гораздо быстрее других штаммов и обладает м.м., меньшей по сравнению с ними на 1000 Д. Согласно данным В.Н. Ляпустина и др. [207], в клетках, инфицированных вирусом КЭ, синтезируется белок С с м.м. 13 кД, а расчетная м.м. этого белка, полученная из аминокислотной последовательности штамма Софьин [267], равняется 12 108 Д. Штаммы, исследованные F. Heinz и Ch. Kunz [473], разделились на две группы: в первую вошли дальневосточные штаммы Софьин и Bars, а также изоляты из бывшей Чехословакии и Финляндии, которые имели белок М с меньшей м.м. (6500— 7000 Д), а во вторую — штаммы из Австрии, Швейцарии и Германии с м.м. белка М около 7500 Д. У антигенно близкого вирусу КЭ вируса ШЭО м.м. белка М была наибольшей и равнялась 9000 Д. Показано, что в инфицированных флавивирусами клетках этот белок не выявлялся, однако был обнаружен гликозилированный протеин с м.м. 19— 23 кД, идентичный неструктурному белку NV2 [210, 450, 467], в связи с чем предположили, что он является предшественником белка М. В последующем такое предположение подтвердилось [385], а белок NV2 был обозначен как ргМ [438].
Нами [30] изучена электрофоретическая подвижность (ЭФП) 42 штаммов вируса клещевого энцефалита, выделенных в различных участках ареала, включая западные районы бывшего СССР, Крым, Северо-Западный, Северный, Центральный районы европейской России, Предуралье, Урал, Западную и Восточную Сибирь, Дальний Восток, а также Центральную Азию. Установлено, что ЭФП высокомолекулярных белков большинства изученных штаммов сходна, в то время как низкомолекулярные белки значительно варьируют по молекулярной массе, что согласуется с данными литературы о наибольшей вариабельности участков РНК флавивирусов, кодирующих белки ns2a, ns2b, ns4b, С и М. ЭФП белков как высокомолекулярной, так и низкомолекулярной зон штамма Софьин не характерна для большинства изученных штаммов, сходство обнаружено только с двумя штаммами из Киргизии. Таким образом, по скорости миграции вирус-специфических белков в ПААГ и, следовательно, молекулярным массам ряда протеинов дальневосточный прототипный вирус не типичен для штаммов, циркулирующих в природных очагах различных ландшафтно-географических районов. Этот вывод, сделанный на достаточно репрезентативном материале, может рассматриваться как еще один аргумент против представления о монолитности вируса КЭ на территории севера европейской части России, Предуралья, Урала, Сибири и Дальнего Востока, где он экологически связан с клещом вида I. persulcatus. Заметим также, что отличия по ЭФП между некоторыми штаммами сопоставимы с таковыми, обнаруженными ранее между некоторыми членами комплекса вирусов клещевого энцефалита [111]. Это давало основание предположить весьма существенные различия первичной структуры их геномов. Отмечено, что наблюдаемая дифференциация в молекулярных массах вирусспе-цифических белков у разных штаммов могла быть обусловлена альтернативными путями и разной скоростью расщепления их предшественников, а в случае гликопротеинов — отличиями в молекулярной массе углеводной части.
А.И. Жанков и др. [110, 111], Т.И. Дживанян и др. [95, 96] исследовали ЭФП белков ряда флавивирусов, в том числе вирусов комплекса КЭ. Показано, что белки NV5, NV4 и V3 вирусов антигенного комплекса КЭ мигрировали в электрофорезе с одинаковой скоростью. Исключение составил вирус Повассан.
Высокомолекулярные белки флавивирусов, переносимых комарами, различались по ЭФП, дифференцировались между собой и от белков вирусов группы КЭ. В клетках, инфицированных последними, обнаружен белок NV4 1/2 с м.м. 79 000 Д, который, по-видимому, является предшественником белка NV4 [457]. В уже упоминавшейся работе [473] отмечалось, что при использовании метода олигопептидного картирования гликопротеины Е флавивирусов ЛЗН, ЭДМ, Росио, КЭ и ШЭО оказались неидёнтичными. Аналогичные результаты получены и авторами [111, 113] в отношении вирусов комплекса КЭ. В соответствии с ними вирусы КЭ, Негиши, ОГЛ, Лангат, ШЭО и Повассан отличались друг от друга расположением олигопептидов белка V3 на пептидных картах. Существенно варьировала также картина разделения олигопептидов белка NV3 вирусов Негиши, КЭ, Лангат и Повассан. Однако неструктурные белки NV5 вирусов Негиши, КЭ и ОГЛ обнаруживали большое сходство, что свидетельствовало о выраженной гомологии их аминокислотных последовательностей.
Синтез вирусспецифических белков вируса клещевого энцефалита исследован также В.Н. Ляпустиным и др. [207, 209], в результате чего выявлены полипептиды р93 (NS5), р69 (NS3), р53 (Е), р47 (NS1), р24, р23, р18, р13 (С), р12. В другой работе эти авторы [206] изучали гликозилирование белков вируса КЭ по включению в них в процессе синтеза в перевиваемых клетках эмбриона свиньи радиоактивных углеводов. Показаны высокая степень гликозилирования белков р53 (Е), р47 (NV3) и р21, а также слабое гликозилирование белка, мигрирующего в геле сходно с белком р13 (NV2 1/2) — аналогом вирионного белка С. Кроме того, зафиксировано небольшое включение метки по 14С-маннозе и 3Н-глюко-замину в белки р93 (NV5), р79 (NV4 1/2) и р69 (NV4). Вместе с тем в литературе имеются различные сведения по данному вопросу, особенно в отношении неструктурных белков. Что же касается белка Е вируса клещевого энцефалита, то он, вероятно, существует в зараженных клетках в двух состояниях — гликозилированном и негликозилированном [206]. Это может проявляться в небольших различиях протяженности его полипептидной цепи и электрофоретической гетерогенности.
Среди неструктурных флавивирусных белков особого упоминания заслуживает так называемый растворимый комплементфиксирующий невирионный антиген. Он обнаруживается в препаратах флавивирусов, не входит в состав вириона и отличается от вирионного антигена, а также медленно седиментирующего гемагглютинина (МСГА) по физико-химическим и серологическим свойствам [47, 442]. Растворимый антиген обладает высокой видоспецифичностью, благодаря чему с его помощью удается четко идентифицировать серотипы вируса денге или географические варианты вируса ЛЗН. В.А. Деменев [92] показал, что растворимые антигены и приготовленные к ним антисыворотки могут быть использованы для серотипирования вирусов комплекса КЭ. Нами проведена работа [122], выявившая возможность антигенного типирования вариантов вируса КЭ в РСК с растворимыми антигенами. С помощью этого методического приема дифференцированы восточный, западный и Айна подтипы, а также обнаружен новый (урало-сибирский) антигенный подтип вируса КЭ, широкая циркуляция которого впоследствии была подтверждена другими методами.
Получение комплементсвязывающего растворимого антигена флавивирусов может быть осуществлено несколькими способами. Его можно отделить от вирионного антигена ультрацентрифугированием, а также получить дифференциальным осаждением из вируссодержащей жидкости полиэтиленгликолем и сульфатом аммония или обработкой антигенного препарата 8М мочевиной [92, 205, 208]. Растворимый антиген проявляет устойчивость к действию додецилсульфата натрия и мочевины, сохраняя при этом активность в РСК и реакции диффузионной преципитации в агаре. В то же время он не обладает способностью агглютинировать эритроциты и вступать в реакцию нейтрализации.
В литературе существует неоднозначная оценка природы растворимого антигена. Так, J. Schlesinger и др. [445, 446], G. Winkler и др. [468], J. Lee и др. [421] показали, что этот вирусспецифический внеклеточный белок флавивирусов не является МСГА или вирионами, а связан с внеклеточным полипептидом NS1. В других работах [85, 86, 204] излагается мнение, согласно которому невирионный антиген вируса КЭ представляет собой комплексную структуру, в состав которой входят белки, углеводы, липиды и РНК. Варьирование составных частей такого комплекса обусловливает гетерогенность невирионного антигена по седиментационным, электрофоретическим и хроматографическим характеристикам. Подчеркивается, что антигенная активность его обеспечивается неструктурным белком NV5 (р93). Расхождение данных различных авторов относительно молекулярной массы растворимого антигена объясняют деградацией NV5 в условиях иммунохимической реакции с образованием ряда химических продуктов. В более поздней публикации [207] те же авторы отметили, что иммунохимическая активность невирионного антигена вируса КЭ обеспечивается неструктурными белками р93 (NS5) и р47 (NS1). G. Winkler и др. [468] в результате анализа лизатов клеток ВНК, зараженных вирусами энцефалита Сан-Луи и Повассан, и белков, выделенных из мозга мышей, зараженных вирусом денге, показали закономерное появление высокомолекулярной формы NS1. Установлено, что она является гомодимером и присуща как растворимому, так и агрегированному внутриклеточному белку NS1. J. Lee и др. [421] обнаружили различие между белком NS1 и растворимым комплементсвязывающим антигеном, которое выражается в дополнительном гликозилировании последнего.
Весьма интересны материалы о протективных свойствах полипротеина NS1. В [443, 446] указывается, что внутрибрюшинное введение мышам дважды в течение 2 нед очищенного белка NS1 вируса ЖЛ, полученного из лизатов инфицированных клеток Vero, защищает 100 % животных от внутрикожного заражения летальной дозой вируса 17D. Двукратная иммунизация обезьян резус белком NS1 в количестве 100 мкг внутрикожно и 500 мкг подкожно приводит к предотвращению гибели этих животных, инфицированных летальной дозой уличного вируса ЖЛ. У обезьян в крови обнаруживали антитела в титре 1:64 — 1:256, а также анти-NSl антитела. Полагают, что защитный эффект белка NS1 обеспечивается за счет комплементопосредованного иммунного цитолиза клеток, несущих поверхностный NS1 антиген. Zhang Yi-Ming и др. [472] путем включения в бакуловирусный вектор ДНК фрагмента вируса денге величиной 4000 пар оснований получили рекомбинантный бакуло-вирус, кодирующий три структурных белка и неструктурные белки NS1 и NS2 вируса денге. В клетках Spodoptera frudiperda, зараженных рекомбинантным бакуло-вирусом, получена продукция белков С, prM, E и NS1, подобных синтезирующимся в клетках обезьян, инфицированных вирусом денге. Инокуляция мышам этих белков приводила к индукции преципитирующих анти-NSl антител и очень слабому синтезу антител против белков Е и ргМ. Несмотря на отсутствие продукции вируснейтрализующих антител, иммунизированные мыши были резистентны к заражению летальной дозой гомологичного вируса.
Расшифровка первичной структуры генома вируса КЭ позволила А.Г. Плетневу и др. [263] сопоставить и оценить с помощью компьютерного анализа уровни гомологии его белков и белков других флавивирусов. Наименьшим оказалось сходство среди низкомолекулярных неструктурных белков NS2A, NS2B, NS4B и вирионных белков М и С.
Максимальная гомология отмечена для белков Е, NS1, NS3 и NS5, причем внутри одной антигенной группы она достигает очень большой степени (у вирусов ЗН и Канджин 92—95 %). Наиболее близки к вирусу КЭ, как выяснилось, полипротеины вируса ЖЛ. Подчеркивается, что несмотря на различный тип переносчиков и географическую разобщенность, флавивирусы, переносимые клещами, имеют однотипную организацию геномов и полипротеинов, по-видимому, сходные механизмы их функционирования в клетках животных, а также высокую степень гомологии белков, необходимых для репродукции вируса.