Общая характеристика риккетсий и риккетсиозов
Эпидемиологическая характеристика риккетсиозов
Накопленные знания о природе, экологических, иммунобиологических и молекулярно-генетических особенностях возбудителей болезней порядка Rickettsiales позволяют характеризовать их как мельчайшие микроорганизмы, паразитирующие преимущественно в клетках тканей членистоногих, теплокровных животных и человека. Многие виды риккетсий постоянно обитают в тканях и органах членистоногих, главным образом клещей, на всех стадиях их жизненного цикла без сокращения продолжительности жизни, нарушения фаз развития и репродуктивной функции.
Питаясь кровью теплокровных животных и часто нападая на человека, клещи играют роль переносчиков и резервуара риккетсий в природе. Риккетсий выделяются в значительных количествах с фекалиями вшей и клещей в окружающую среду, в том числе и на шерстный покров животных-прокормителей. Это имеет важное эпидемиологическое значение в дальнейшей трансмиссии возбудителей риккетсиозов.
Как возбудители так называемых клещевых риккетсиозов риккетсий способны существовать в природной среде неопределенно долго, вне какой-либо связи с человеком, обуславливая природную очаговость этих инфекций. Возбудитель же вшивого сыпного тифа — Rickettsia prowazekii — размножается и может персистировать только в организме человека; заражение последнего происходит путем втирания инфицированных экскрементов платяных вшей в кожу при расчесывании, либо при вдыхании их после высыхания. Через укусы вшей заражение невозможно, поскольку в их слюне и ротовом аппарате возбудитель инфекции не содержится. В теле платяных и головных вшей сыпнотифозные риккетсий заселяют эпителиальные клетки кишечника, где интенсивно размножаются и формируют необратимый патологический процесс. Происходит набухание и отслоение инфицированных клеток вплоть до нарушения анатомической целостности пищеварительного тракта, что неизменно приводит к гибели насекомых.
Промежуточное положение по связи с переносчиком и исходу такой связи занимает возбудитель крысиного (эндемического) риккетсиоза. Поддержание и сохранение в природе этого возбудителя связано преимущественно с блохами вида Xenopsylla cheopis, питающихся кровью крыс. Механизм заражения человека возбудителем крысиного риккетсиоза принципиально не отличается от такового при эпидемическом сыпном тифе и окопной (волынской, или траншейной) лихорадке, и поэтому ему присущ фекально-ингаляционно-контактный путь передачи инфекции.
Заражение людей возбудителями клещевых риккетсиозов, наоборот, чаще обуславливается нападением и присасыванием различных видов клещей. Однако несомненно, что значительное количество заражений реализуется путем вдыхания инфицированной риккетсиями, а также Coxiella burnetii, пыли, образовавшейся в окружающей среде из фекалий, выделяемых клещами в процессе кровососания и содержащих огромное количество жизнеспособных возбудителей.
Возникающий после инфицирования, в результате заселения риккетсиями организма теплокровных животных, процесс сопровождается генерализованным поражением эндотелия сосудов, что обуславливает последующее многообразие клинических проявлений болезни. Развиваются различной выраженности эндоваскулиты и тромбангииты в конечных сосудах сосочкового слоя кожи (сыпь!), а нередко и гангрена концевых фаланг, мочек ушей и других частей тела.
Этот процесс проявляется у человека постепенным, по мере внутриклеточного размножения риккетсий и разрушения инфицированных клеток, развитием инфекционно-токсического синдрома. Появляются и нарастают лихорадочная реакция, симптомы токсикоза, нарушается функция сердечно-сосудистой системы, на слизистых оболочках и на коже формируется сыпь различной выраженности и продолжительности, резко нарушается субъективное состояние больного. При злокачественно протекающих риккетсиозах, таких как вшивый (эпидемический) сыпной тиф и пятнистая лихорадка Скалистых гор, а также лихорадка цуцугамуши, и отсутствии специфического лечения (антибиотикотерапии) у 5-20% больных наступает летальный исход.
Патогенные для человека риккетсий 20 отдельных видов таксономически принадлежат к семействам Rickettsiaceae и Bartonellaceae. По комплексу экологических и антигенных свойств и особенностям клинического течения заболевания у человека условно разделены на 5 групп. Название болезни отображает либо географическое место первого выявления ее в отдельную нозологическую форму, либо характерную для нее эпидемиологическую особенность, например клещевой риккетсиоз Северной Азии, пятнистая лихорадка Скалистых гор, окопная (траншейная, или волынская) лихорадка и т. д.
Таблица 3. Заболеваемостьриккетсиозами населения России (до 1991г. - населения СССР)
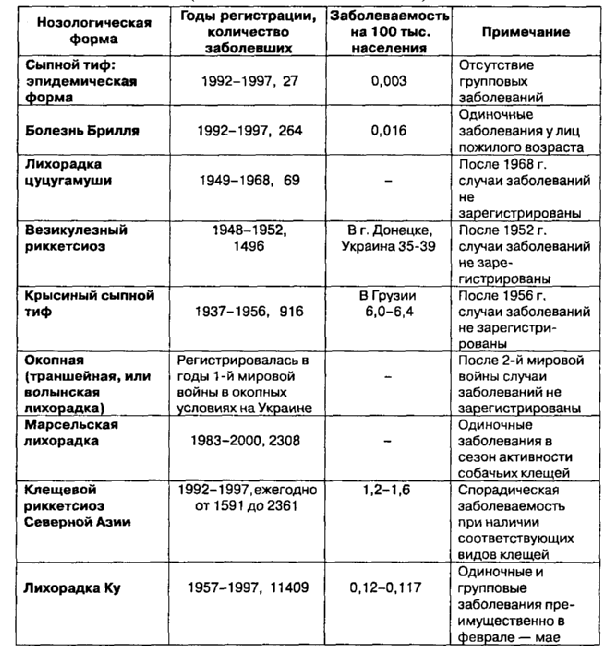
На основании оценки эпидемиологической значимости риккетсиозов, когда-либо обнаруженных и регистрируемых на территории бывшего СССР, их разделяют на две группы: 1-ю — имеющие большую значимость для общественного здравоохранения; 2-ю — малоугрожающие инфекции (табл. 3). Так, например, оспоподобный (везикулезный) и крысиный риккетсиозы, частично марсельская лихорадка имели строго ограниченную привязанность к территориям, благоприятным для сосуществования биоценоза возбудитель — переносчик — прокормитель. Благодаря интенсивным дератизационно-дезинсекционным мероприятиям в 50-е годы эндемичные очаги этих инфекций были быстро ликвидированы. В последние 40 лет заболевания данными риккетсиозами как внутри прежних очагов проявления, так и за их пределами на территориях Украины, Крыма и Грузии отсутствуют.
Аналогичное положение сложилось и с окопной (волынской или траншейной) лихорадкой. После значительных вспышек в русской армии в период Первой мировой войны в зоне боевых действий на территории Западной Украины данный риккетсиоз не регистрируется.
Однако в результате обширных серологических исследований иммунологической структуры населения Украины и за ее пределами установлено наличие специфических антител к В. quintana болезни во всех возрастных группах людей в 1,7-6,3% случаев. Эти факты следует расценивать как бесспорное свидетельство скрытой циркуляции возбудителя инфекции в биоценозной цепи вошь — человек. Очевидно, что при возрастании численности переносчика и его инфицированной доли может возникнуть угроза возврата вспышек окопной лихорадки.
Небезынтересно также отметить, что по последним сообщениям зарубежных авторов, Rickettsia (с 1993 г. - Bartonella) quintana не является столь безобидным возбудителем, как это представлялось до 90-х годов. Нередко наблюдается тенденция к хронизации инфекционного процесса с персистенцией возбудителя в эндотелиальных тканях. В последующем поражаются клапаны сердца, развиваются сердечно-сосудистая недостаточность и другие осложнения.
Установлена этиологическая причастность бартонелл и к так называемой болезни кошачьих царапин (cat scratch diseases) — доброкачественного заболевания, сопровождающегося лихорадкой, регионарным лимфаденитом, воспалением и отеком в местах царапин, а в некоторых случаях — ангиоматозом с высокой вероятностью осложнений в виде эндокардита. В России и в других странах официально болезнь кошачьих царапин не регистрируется, поэтому распространенность ее не известна. Ее истинную роль в этиологии различных болезненных состояний человека еще предстоит выяснить. В связи с особенностями экологии возбудителя инфекции и, возможно, его незначительной распространенностью в России, а также своеобразием механизма передачи (только через кошек и паразитирующих на них кошачьих блох) эпидемиологическая значимость болезни кошачьих царапин, несомненно, подлежит изучению.
Аналогичной оценки применительно к территории России заслуживает также лихорадка цуцугамуши. Действительно, за все годы изучения этой болезни в СССР были выявлены лишь два ограниченных эндемичных очага циркуляции возбудителя: на крайнем юге Приморского края и в Таджикистане. Соответственно, по сводным данным, учтено всего 69 случаев заболеваний людей в 1949-1968 гг. Официальной регистрации лихорадки цуцугамуши в России (СССР) не было. Особый интерес с эколого-эпидемиологических позиций представляет история выявления и изучения в СССР, а затем и в России прыщевого риккетсиоза (марсельская лихорадка). Обнаруженные в 30-50-е годы очаги лихорадки в Крыму и Абхазии в результате интенсивных противоклещевых и ветеринарных мероприятий были быстро ликвидированы. Однако в 70-80-е годы в связи с лихорадочными заболеваниями неясной этиологии, возникавшими преимущественно летом и сопровождавшимися сыпью, нередко формированием первичного аффекта («черное пятно») в месте присасывания клеща, интерес к патологии проявляется вновь.
В ранее известных эндемических очагах на территории СССР, а также в европейских странах с высоким уровнем заболеваемости марсельской лихорадкой (Италия, Испания, Франция и др.) основным переносчиком R. conorii обычно является коричневый южный собачийклещ Rhipicephalus sanguineus. Для него характерен многохозяинный тип питания, что вовлекает в цикл циркуляции риккетсий помимо ежей, зайцев и грызунов также домашних собак. Люди заражаются при уходе за собаками (при присасывании клеща или аэрогенно). Аэрогенный путь заражения обусловлен тем, что многие, удаляя с собак клещей, их раздавливают. В результате из гемолимфы клещей создается аэрозоль. Эта болезнь природно-очаговая. Связь с возможными ареалами возбудителя в бассейне Каспийского моря и, возможно, на Северном Кавказе нуждается в изучении. Как и при других риккетсиозах клещевой группы, своевременно организованные адекватные мероприятия по борьбе с клещами и санитарная пропаганда среди населения представляются эффективными средствами профилактики, позволяющими полностью предупредить заболевания людей.
В 70-80-е годы был отмечен подъем заболеваемости риккетсиозами клещевой группы во многих странах мира, включая и Россию (табл. 4). Очевидно, что такую тенденцию в глобальном масштабе нельзя объяснить действием каких-то местных факторов или климатических изменений в том или ином регионе земного шара. Скорее всего подъем заболеваемости болезнями, с четко выраженным природно-очаговым характером поддержания и распространения возбудителя, обусловлен усилившимся «давлением» человека на природу и, вследствие этого, многократно возросшей вероятностью встречи человека с клещами-переносчиками клещевых болезней (Коренберг Э. И., 1993). Такое объяснение подтверждается сходным возрастанием других инфекционных заболеваний, связанных с аналогичным переносчиком в этот же период, таких как клещевой энцефалит и клещевой боррелиоз (болезнь Лайма) (табл. 4).
Таблица 4.
Заболеваемостьриккетсиозами клещевой группы в некоторых странах и России в 1979-1997 гг.
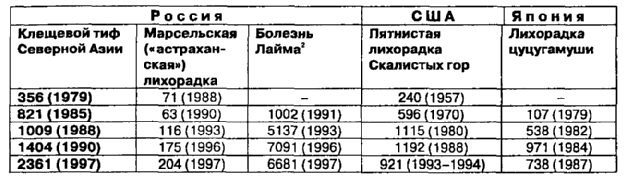
Примечание:
В скобках - годы наблюдения.
Болезнь Лайма - не относится к риккетсиозам, приведена для сравнения, официальная регистрация в России введена с 1991 года.
Относительно спорной проблемой остается прогностическая оценка эпидемиологической значимости болезни Брилля. Прогноз развития последней несложен. По мере возрастания срока после периодов эпидемической активности в результате естественных демографических процессов вероятность появления рецидивной формы тифа прогрессивно снижается. Так, если в России в 50-70-е годы XX века ежегодно регистрировалось несколько тысяч случаев болезни Брилля, то в 80-е годы — несколько сотен, а в 90-е годы — всего 40-50.
По оценкам специалистов, рецидив у перенесших первичный сыпной тиф реализуется в среднем один раз в 20 лет и ежегодно составляет один случай болезни Брилля на 1000 ранее переболевших. При наличии вшей, отсутствии санитарно-гигиенических навыков и ухудшении социально-бытовых условий жизни больные с рецидивной формой могут быть источниками небольшой заболеваемости эпидемическим сыпным тифом.
В последние 25 лет сыпной тиф в России, по данным официальной регистрации, более чем на 90% представлен именно болезнью Брилля.
Эпидемическая форма также учитывается исключительно в виде одиночных заболеваний в старших возрастных группах населения различных регионов страны. Отсутствие заболевания у детей и подростков, составляющих наиболее завшивленную часть населения, и отсутствие сероположительных к возбудителю лиц в данной и более старших (до 30-40 лет) возрастных группах, несомненно, является эпидемиологическим доказательством ограничения и прекращения циркуляции R. prowazekii в популяции (!). Следовательно, население России, Украины и стран Юго-Восточной Европы, охваченное в годы Первой и Второй мировых войн эпидемиями сыпного тифа, переболев, постепенно «очищается» от персистирующего в организме специфического возбудителя. Соответственно снижается опасность возникновения эпидемической формы сыпного тифа за счет нераспознанных своевременно случаев болезни Брилля.
Учитывая экологические особенности возбудителя данного риккетсиоза с позиций «привязанности» только к человеку и возможность распространения исключительно через вшей, а также необходимость высокого уровня (не менее 20-28%) завшивленности населения для формирования эпидемического процесса, следует констатировать, что упомянутые условия возникновения вспышек эпидемического сыпного тифа в России в настоящее время отсутствуют. Незначительность педикулеза, не более 1%, высокая разреженность возможных источников инфекции в виде сыпнотифозных больных обеими формами и растянутость развития эпидемического процесса, свойственная первичному тифу от первых случаев заболеваний до разрастания в групповые вспышки и последующую эпидемию на период до 2,5-3 мес, недостаточны для распространения болезни. Очевидно, явной угрозы распространения сыпного тифа в стране и в ближайшем зарубежье не существует.
Из опыта работы с сыпным тифом в годы Второй мировой войны в Мексике, Италии, Германии, а также в период войны в Корее (1950— 1953) известно, что энергичное применение противопедикулезных средств, даже без санитарно-гигиенической помывки людей (населения или насильственно удерживаемых лиц) и смены белья и одежды, обрывало в течение 2 недель самые жестокие эпидемии. Крайне редкие случаи заболеваний обеими формами сыпного тифа в стране при завшивленности, не превышающей обычный уровень у здорового населения, и при наличии вполне доступных и высокоэффективных педикулицидов дают полную уверенность в том, что любая вспышка риккетсиоза Провачека будет немедленно ликвидирована. Затруднение представляет только установление истинного диагноза первых случаев болезни.
Появление в годы Второй мировой войны, а затем и после ее окончания новых эффективных инсектицидов, а также антибиотиков широкого спектра действия, в первую очередь тетрациклинов, качественно изменило эпидемиологию сыпнотифозных лихорадок. К настоящему времени вшивый сыпной тиф как нозологическая форма болезни ликвидирован почти во всех странах мира.
Остались лишь очаги на территориях Эфиопии, Руанды, Бурунди и в отдельных странах Латинской Америки. Климатогеографические особенности этих стран, связанные с горным характером местности, низким уровнем жизни населения и гражданские войны усугубляют эпидемиологическую ситуацию по этому риккетсиозу. К концу 70-х годов XX века эпидемии там прекратились, но истинное число заболевших остается неизвестным, поскольку с начала 70-х годов вшивый сыпной тиф исключен из числа инфекций, подлежащих обязательной регистрации в ВОЗ из-за повсеместного исчезновения. Что же касается эндемичных по данному риккетсиозу в прошлом стран Балканского полуострова, а также Ближнего и Среднего Востока, то возникавшие там в последние 30-40 лет войны, сопровождавшиеся миграцией населения из зон военных конфликтов, не были осложнены эпидемиями сыпного тифа. Действия советских войск в Афганистане (1979-1989), а также федеральных войск в Чеченской Республике (1994-1996) также не вызвали вспышек риккетсиозов, в том числе и сыпного тифа. Этот опыт подкрепляет уверенность в том, что принятая в России система санитарно-эпидемиологического надзора позволяет своевременно и эффективно предупреждать возможное распространение сыпнотифозного риккетсиоза.
Наиболее распространенным в России, но ограниченным только регионами Сибири и Дальнего Востока, является клещевой риккетсиоз Северной Азии. Его обязательная регистрация введена в 1979 г., и за последующие 16 лет было учтено 19328 случаев этой болезни с почти шестикратным возрастанием заболеваемости. В 1993-1994 гг. на Алтайский край приходилось 34% ежегодной заболеваемости, на Республику Алтай и Хакасию — 15%, Красноярский край — 11%,а остальные 40% заболеваемости — на 10 других административных территорий Сибири и Дальнего Востока, эндемичных по данному риккетсиозу. Наиболее высокая заболеваемость отмечалась в Республике Алтай — 54,9-65,4 на 100 тыс. населения и Алтайском крае — 21,6-38,8 при среднем для России уровне, равном 1,2-1,5. Эндемические активные очаги клещевого риккетсиоза обнаружены в последние годы в Тюменской и Курганской областях. Эпидемиологически значимыми переносчиками являются многочисленные виды инфицированных клещей рода Dermacentor, постоянно обитающие на обширных степных, лесостепных и горных пространствах Сибири и Дальнего Востока. В Алтайском крае их риккетсиоформность достигает, например, 1,7%, на юге Красноярского края — 2,75%. Заражение населения происходит преимущественно весной и летом в природных стациях клещей, что совпадает с периодом активности imago после зимней спячки. Увеличение в 2,7 раза заболеваемости клещевым риккетсиозом в последние 10 лет (с 821 до 2361 случаев) объясняется повышением контактов населения, особенно городского, с переносчиками в связи с хозяйственным освоением территорий, где существуют природные очаги возбудителя и сохраняется высокая численность клещей.
В результате трансформации природных очагов риккетсиозов под воздействием человека, например, при вырубке леса и кустарника, распашке лугов, прекращении выпаса животных, постепенно уменьшается численность клещей, соответственно и снижается заболеваемость. Процесс этот длится несколько лет. Именно по этой причине на эндемичных территориях отмечены природные очаги со «стабильной» из года в год заболеваемостью в зоне горных степей и лесостепей южных горных областей Сибири (Алтайский край и Горный Алтай). Медленное снижение заболеваемости вследствие ландшафтной трансформации территорий отмечено и в других регионах.
Общая картина эпидемиологических проявлений клещевого риккетсиоза за все годы наблюдений не изменилась. Она имеет рассеянный по территориям и времени характер изолированных друг от друга заболеваний. Своевременно и энергично проводимые противоклещевые мероприятия существенно влияют на заболеваемость.
Близкой по своим эколого-эпидемиологическим особенностям к R. sibirica, возбудителю клещевого риккетсиоза, является возбудитель лихорадки Ку — Coxiella burnetii. Он сохраняется и циркулирует на территории России в многочисленных природных очагах. Заболевания людей отмечены более чем на 50 административных территориях. Официально она регистрируется с 1957 г. С этого времени заболеваемость лихорадкой Ку возросла почти в 17 раз, с 0 до одного случая на 100 тыс. населения, благодаря в основном повышению знаний об этой инфекции и улучшению ее диагностики. Однако по прежнему распознавание коксиеллеза значительно затрудняется вследствие полиморфности клинического течения болезни. По отдаленным последствиям коксиеллез также опасен, как и бартонеллез, поскольку примерно у 10% нелеченных своевременно больных развивается эндокардит.
Экологическая особенность лихорадки Ку состоит в возникновении помимо природных очагов многочисленных ареалов возбудителя, связанных с хозяйственной деятельностью человека. В последние годы такие очаги, главным образом «козье-овечьего» типа, зарегистрированы не только в европейской, но и в азиатской части России: 32,4% заболевших в Астраханской области, 24,1% — в Новосибирской и 12,5% — в Воронежской. Заражения в основном возникают в периоды отела и окота сельскохозяйственных животных — в феврале-мае, что обусловливает повышение заболеваемости населения сельскохозяйственных районов. Известны многие случаи групповых заболеваний (до 100 человек), связанные с переработкой продуктов животноводства, в частности козьего пуха, или же с прогоном через населенные пункты заклещевленных овец с высокой инфицированностью переносчика коксиеллами.
Для лихорадки Ку наиболее распространенным путем передачи инфекции является аэрогенный. В литературе упоминаются заражения алиментарным путем через инфицированное молоко и мясопродукты, а также через укусы клещей. Исходя из эпидемиологии и экологических особенностей возбудителя коксиеллеза в его профилактике важное значение приобретают санитарно-ветеринарный контроль, в частности выбраковка больных животных из зараженных отар и животноводческих хозяйств, а также усиление роли санитарно-эпидемиологического надзора и эпизоотологического контроля за инфекцией.
Патологический процесс при риккетсиозах человека обуславливается тем, что риккетсии, за исключением С. burnetii (см. «Лихорадку Ку»), размножаются главным образом в эндотелиальных клетках, выстилающих стенки кровеносных сосудов, особенно мелких, где на месте их паразитирования образуются специфические для данной патологии микроскопически выявляемые образования — узелки (гранулемы). Подробнее материалы о патогенезе и патологической анатомии представлены для каждой нозологической формы в отдельности.
В клиническом отношении все риккетсиозы человека являются остро протекающими циклическими болезнями с выраженной интоксикацией, часто тифозным состоянием, характерным симптомокомплексом со стороны центральной нервной системы и сосудистого аппарата, наличием характерной экзантемы (кроме лихорадки Ку). При этом, однако, каждый риккетсиоз имеет свою достаточно типичную клиническую картину, что будет видно из описания соответствующих нозологических форм. При лихорадке Ку возможно и хроническое течение процесса.
Во время болезни и после нее при риккетсиозах создается обычно стойкий иммунитет. По данным П. Ф. Здродовского, он двупрофильный — антиинфекционный и антитоксический. Выявление в последние годы фактов длительного сохранения возбудителей риккетсиозов в организме человека и животных как в случаях естественной передачи, так и при экспериментальной инфекции позволяет многим исследователям говорить о так называемом нестерильном, т. е. инфекционном, иммунитете, в то время как другие отвергают такую возможность. Наблюдавшуюся повторную заболеваемость при некоторых риккетсиозах, в частности болезни Брилля, одни авторы рассматривают как новое заражение (экзогенная инфекция) при условии угасания иммунитета, а другие — как следствие активизации сохранившихся в организме возбудителей после первичной инфекции, но опять-таки при условии угасания иммунитета и снижения общей реактивности макроорганизма (эндогенная инфекция).
Выявление иммунологических свойств организма при риккетсиозах достигается в практической работе с помощью серологических реакций — реакций агглютинации с соответствующими риккетсиями, особенно реакции макроагглютинации по Вейглю, а также путем использования реакции гемагглютинации, реакции связывания комплемента, реакции нейтрализации токсического действия риккетсий, реакции кольцепреципитации, благодаря которым выявляются специфические антитела, и, наконец, с помощью аллергических проб. Указанные иммунологические тесты обычно и служат целям идентификации риккетсий и риккетсиозов.
Наряду с этим в настоящее время в качестве серологического теста используется реакция Вейля-Феликса, предложенная еще в 1916 г. Weil и Felix с использованием штаммов ОХ19 и ОХ2 Proteus vulgaris и штамма ОХК Proteus mirabilis, которые имеют в своем составе общий с риккетсиозами антиген (термостабильный глюцидо-липидный комплекс). Эта реакция групповая и выявляется почти при всех риккетсиозах человека, что позволяет дифференцировать их от других болезней. При некоторых же риккетсиозах реакция Вейля-Феликса всегда (лихорадка Ку) или почти всегда (везикулезный риккетсиоз) дает отрицательные результаты.
Наконец, в последние годы в целях возможно быстрого выявления и серологической идентификации риккетсий, причем не только жизнеспособных, но погибших и даже распавшихся, а также растворимого антигена используется люминесцентно-серологический метод исследования.
В настоящее время по предположению многих исследователей все риккетсиозы по их этиологической, иммунологической и эпидемиологической сущности, патогенезу и клинической картине болезни подразделяют на 6 групп. В табл. 1 дана общая характеристика их с представлением ряда общих сведений по отдельным нозологическим формам.
Накопленные знания о природе, экологических, иммунобиологических и молекулярно-генетических особенностях возбудителей болезней порядка Rickettsiales позволяют характеризовать их как мельчайшие микроорганизмы, паразитирующие преимущественно в клетках тканей членистоногих, теплокровных животных и человека. Многие виды риккетсий постоянно обитают в тканях и органах членистоногих, главным образом клещей, на всех стадиях их жизненного цикла без сокращения продолжительности жизни, нарушения фаз развития и репродуктивной функции.
Питаясь кровью теплокровных животных и часто нападая на человека, клещи играют роль переносчиков и резервуара риккетсий в природе. Риккетсий выделяются в значительных количествах с фекалиями вшей и клещей в окружающую среду, в том числе и на шерстный покров животных-прокормителей. Это имеет важное эпидемиологическое значение в дальнейшей трансмиссии возбудителей риккетсиозов.
Как возбудители так называемых клещевых риккетсиозов риккетсий способны существовать в природной среде неопределенно долго, вне какой-либо связи с человеком, обуславливая природную очаговость этих инфекций. Возбудитель же вшивого сыпного тифа — Rickettsia prowazekii — размножается и может персистировать только в организме человека; заражение последнего происходит путем втирания инфицированных экскрементов платяных вшей в кожу при расчесывании, либо при вдыхании их после высыхания. Через укусы вшей заражение невозможно, поскольку в их слюне и ротовом аппарате возбудитель инфекции не содержится. В теле платяных и головных вшей сыпнотифозные риккетсий заселяют эпителиальные клетки кишечника, где интенсивно размножаются и формируют необратимый патологический процесс. Происходит набухание и отслоение инфицированных клеток вплоть до нарушения анатомической целостности пищеварительного тракта, что неизменно приводит к гибели насекомых.
Промежуточное положение по связи с переносчиком и исходу такой связи занимает возбудитель крысиного (эндемического) риккетсиоза. Поддержание и сохранение в природе этого возбудителя связано преимущественно с блохами вида Xenopsylla cheopis, питающихся кровью крыс. Механизм заражения человека возбудителем крысиного риккетсиоза принципиально не отличается от такового при эпидемическом сыпном тифе и окопной (волынской, или траншейной) лихорадке, и поэтому ему присущ фекально-ингаляционно-контактный путь передачи инфекции.
Заражение людей возбудителями клещевых риккетсиозов, наоборот, чаще обуславливается нападением и присасыванием различных видов клещей. Однако несомненно, что значительное количество заражений реализуется путем вдыхания инфицированной риккетсиями, а также Coxiella burnetii, пыли, образовавшейся в окружающей среде из фекалий, выделяемых клещами в процессе кровососания и содержащих огромное количество жизнеспособных возбудителей.
Возникающий после инфицирования, в результате заселения риккетсиями организма теплокровных животных, процесс сопровождается генерализованным поражением эндотелия сосудов, что обуславливает последующее многообразие клинических проявлений болезни. Развиваются различной выраженности эндоваскулиты и тромбангииты в конечных сосудах сосочкового слоя кожи (сыпь!), а нередко и гангрена концевых фаланг, мочек ушей и других частей тела.
Этот процесс проявляется у человека постепенным, по мере внутриклеточного размножения риккетсий и разрушения инфицированных клеток, развитием инфекционно-токсического синдрома. Появляются и нарастают лихорадочная реакция, симптомы токсикоза, нарушается функция сердечно-сосудистой системы, на слизистых оболочках и на коже формируется сыпь различной выраженности и продолжительности, резко нарушается субъективное состояние больного. При злокачественно протекающих риккетсиозах, таких как вшивый (эпидемический) сыпной тиф и пятнистая лихорадка Скалистых гор, а также лихорадка цуцугамуши, и отсутствии специфического лечения (антибиотикотерапии) у 5-20% больных наступает летальный исход.
Патогенные для человека риккетсий 20 отдельных видов таксономически принадлежат к семействам Rickettsiaceae и Bartonellaceae. По комплексу экологических и антигенных свойств и особенностям клинического течения заболевания у человека условно разделены на 5 групп. Название болезни отображает либо географическое место первого выявления ее в отдельную нозологическую форму, либо характерную для нее эпидемиологическую особенность, например клещевой риккетсиоз Северной Азии, пятнистая лихорадка Скалистых гор, окопная (траншейная, или волынская) лихорадка и т. д.
Таблица 3. Заболеваемостьриккетсиозами населения России (до 1991г. - населения СССР)

На основании оценки эпидемиологической значимости риккетсиозов, когда-либо обнаруженных и регистрируемых на территории бывшего СССР, их разделяют на две группы: 1-ю — имеющие большую значимость для общественного здравоохранения; 2-ю — малоугрожающие инфекции (табл. 3). Так, например, оспоподобный (везикулезный) и крысиный риккетсиозы, частично марсельская лихорадка имели строго ограниченную привязанность к территориям, благоприятным для сосуществования биоценоза возбудитель — переносчик — прокормитель. Благодаря интенсивным дератизационно-дезинсекционным мероприятиям в 50-е годы эндемичные очаги этих инфекций были быстро ликвидированы. В последние 40 лет заболевания данными риккетсиозами как внутри прежних очагов проявления, так и за их пределами на территориях Украины, Крыма и Грузии отсутствуют.
Аналогичное положение сложилось и с окопной (волынской или траншейной) лихорадкой. После значительных вспышек в русской армии в период Первой мировой войны в зоне боевых действий на территории Западной Украины данный риккетсиоз не регистрируется.
Однако в результате обширных серологических исследований иммунологической структуры населения Украины и за ее пределами установлено наличие специфических антител к В. quintana болезни во всех возрастных группах людей в 1,7-6,3% случаев. Эти факты следует расценивать как бесспорное свидетельство скрытой циркуляции возбудителя инфекции в биоценозной цепи вошь — человек. Очевидно, что при возрастании численности переносчика и его инфицированной доли может возникнуть угроза возврата вспышек окопной лихорадки.
Небезынтересно также отметить, что по последним сообщениям зарубежных авторов, Rickettsia (с 1993 г. - Bartonella) quintana не является столь безобидным возбудителем, как это представлялось до 90-х годов. Нередко наблюдается тенденция к хронизации инфекционного процесса с персистенцией возбудителя в эндотелиальных тканях. В последующем поражаются клапаны сердца, развиваются сердечно-сосудистая недостаточность и другие осложнения.
Установлена этиологическая причастность бартонелл и к так называемой болезни кошачьих царапин (cat scratch diseases) — доброкачественного заболевания, сопровождающегося лихорадкой, регионарным лимфаденитом, воспалением и отеком в местах царапин, а в некоторых случаях — ангиоматозом с высокой вероятностью осложнений в виде эндокардита. В России и в других странах официально болезнь кошачьих царапин не регистрируется, поэтому распространенность ее не известна. Ее истинную роль в этиологии различных болезненных состояний человека еще предстоит выяснить. В связи с особенностями экологии возбудителя инфекции и, возможно, его незначительной распространенностью в России, а также своеобразием механизма передачи (только через кошек и паразитирующих на них кошачьих блох) эпидемиологическая значимость болезни кошачьих царапин, несомненно, подлежит изучению.
Аналогичной оценки применительно к территории России заслуживает также лихорадка цуцугамуши. Действительно, за все годы изучения этой болезни в СССР были выявлены лишь два ограниченных эндемичных очага циркуляции возбудителя: на крайнем юге Приморского края и в Таджикистане. Соответственно, по сводным данным, учтено всего 69 случаев заболеваний людей в 1949-1968 гг. Официальной регистрации лихорадки цуцугамуши в России (СССР) не было. Особый интерес с эколого-эпидемиологических позиций представляет история выявления и изучения в СССР, а затем и в России прыщевого риккетсиоза (марсельская лихорадка). Обнаруженные в 30-50-е годы очаги лихорадки в Крыму и Абхазии в результате интенсивных противоклещевых и ветеринарных мероприятий были быстро ликвидированы. Однако в 70-80-е годы в связи с лихорадочными заболеваниями неясной этиологии, возникавшими преимущественно летом и сопровождавшимися сыпью, нередко формированием первичного аффекта («черное пятно») в месте присасывания клеща, интерес к патологии проявляется вновь.
В ранее известных эндемических очагах на территории СССР, а также в европейских странах с высоким уровнем заболеваемости марсельской лихорадкой (Италия, Испания, Франция и др.) основным переносчиком R. conorii обычно является коричневый южный собачийклещ Rhipicephalus sanguineus. Для него характерен многохозяинный тип питания, что вовлекает в цикл циркуляции риккетсий помимо ежей, зайцев и грызунов также домашних собак. Люди заражаются при уходе за собаками (при присасывании клеща или аэрогенно). Аэрогенный путь заражения обусловлен тем, что многие, удаляя с собак клещей, их раздавливают. В результате из гемолимфы клещей создается аэрозоль. Эта болезнь природно-очаговая. Связь с возможными ареалами возбудителя в бассейне Каспийского моря и, возможно, на Северном Кавказе нуждается в изучении. Как и при других риккетсиозах клещевой группы, своевременно организованные адекватные мероприятия по борьбе с клещами и санитарная пропаганда среди населения представляются эффективными средствами профилактики, позволяющими полностью предупредить заболевания людей.
В 70-80-е годы был отмечен подъем заболеваемости риккетсиозами клещевой группы во многих странах мира, включая и Россию (табл. 4). Очевидно, что такую тенденцию в глобальном масштабе нельзя объяснить действием каких-то местных факторов или климатических изменений в том или ином регионе земного шара. Скорее всего подъем заболеваемости болезнями, с четко выраженным природно-очаговым характером поддержания и распространения возбудителя, обусловлен усилившимся «давлением» человека на природу и, вследствие этого, многократно возросшей вероятностью встречи человека с клещами-переносчиками клещевых болезней (Коренберг Э. И., 1993). Такое объяснение подтверждается сходным возрастанием других инфекционных заболеваний, связанных с аналогичным переносчиком в этот же период, таких как клещевой энцефалит и клещевой боррелиоз (болезнь Лайма) (табл. 4).
Таблица 4.
Заболеваемостьриккетсиозами клещевой группы в некоторых странах и России в 1979-1997 гг.

Примечание:
В скобках - годы наблюдения.
Болезнь Лайма - не относится к риккетсиозам, приведена для сравнения, официальная регистрация в России введена с 1991 года.
Относительно спорной проблемой остается прогностическая оценка эпидемиологической значимости болезни Брилля. Прогноз развития последней несложен. По мере возрастания срока после периодов эпидемической активности в результате естественных демографических процессов вероятность появления рецидивной формы тифа прогрессивно снижается. Так, если в России в 50-70-е годы XX века ежегодно регистрировалось несколько тысяч случаев болезни Брилля, то в 80-е годы — несколько сотен, а в 90-е годы — всего 40-50.
По оценкам специалистов, рецидив у перенесших первичный сыпной тиф реализуется в среднем один раз в 20 лет и ежегодно составляет один случай болезни Брилля на 1000 ранее переболевших. При наличии вшей, отсутствии санитарно-гигиенических навыков и ухудшении социально-бытовых условий жизни больные с рецидивной формой могут быть источниками небольшой заболеваемости эпидемическим сыпным тифом.
В последние 25 лет сыпной тиф в России, по данным официальной регистрации, более чем на 90% представлен именно болезнью Брилля.
Эпидемическая форма также учитывается исключительно в виде одиночных заболеваний в старших возрастных группах населения различных регионов страны. Отсутствие заболевания у детей и подростков, составляющих наиболее завшивленную часть населения, и отсутствие сероположительных к возбудителю лиц в данной и более старших (до 30-40 лет) возрастных группах, несомненно, является эпидемиологическим доказательством ограничения и прекращения циркуляции R. prowazekii в популяции (!). Следовательно, население России, Украины и стран Юго-Восточной Европы, охваченное в годы Первой и Второй мировых войн эпидемиями сыпного тифа, переболев, постепенно «очищается» от персистирующего в организме специфического возбудителя. Соответственно снижается опасность возникновения эпидемической формы сыпного тифа за счет нераспознанных своевременно случаев болезни Брилля.
Учитывая экологические особенности возбудителя данного риккетсиоза с позиций «привязанности» только к человеку и возможность распространения исключительно через вшей, а также необходимость высокого уровня (не менее 20-28%) завшивленности населения для формирования эпидемического процесса, следует констатировать, что упомянутые условия возникновения вспышек эпидемического сыпного тифа в России в настоящее время отсутствуют. Незначительность педикулеза, не более 1%, высокая разреженность возможных источников инфекции в виде сыпнотифозных больных обеими формами и растянутость развития эпидемического процесса, свойственная первичному тифу от первых случаев заболеваний до разрастания в групповые вспышки и последующую эпидемию на период до 2,5-3 мес, недостаточны для распространения болезни. Очевидно, явной угрозы распространения сыпного тифа в стране и в ближайшем зарубежье не существует.
Из опыта работы с сыпным тифом в годы Второй мировой войны в Мексике, Италии, Германии, а также в период войны в Корее (1950— 1953) известно, что энергичное применение противопедикулезных средств, даже без санитарно-гигиенической помывки людей (населения или насильственно удерживаемых лиц) и смены белья и одежды, обрывало в течение 2 недель самые жестокие эпидемии. Крайне редкие случаи заболеваний обеими формами сыпного тифа в стране при завшивленности, не превышающей обычный уровень у здорового населения, и при наличии вполне доступных и высокоэффективных педикулицидов дают полную уверенность в том, что любая вспышка риккетсиоза Провачека будет немедленно ликвидирована. Затруднение представляет только установление истинного диагноза первых случаев болезни.
Появление в годы Второй мировой войны, а затем и после ее окончания новых эффективных инсектицидов, а также антибиотиков широкого спектра действия, в первую очередь тетрациклинов, качественно изменило эпидемиологию сыпнотифозных лихорадок. К настоящему времени вшивый сыпной тиф как нозологическая форма болезни ликвидирован почти во всех странах мира.
Остались лишь очаги на территориях Эфиопии, Руанды, Бурунди и в отдельных странах Латинской Америки. Климатогеографические особенности этих стран, связанные с горным характером местности, низким уровнем жизни населения и гражданские войны усугубляют эпидемиологическую ситуацию по этому риккетсиозу. К концу 70-х годов XX века эпидемии там прекратились, но истинное число заболевших остается неизвестным, поскольку с начала 70-х годов вшивый сыпной тиф исключен из числа инфекций, подлежащих обязательной регистрации в ВОЗ из-за повсеместного исчезновения. Что же касается эндемичных по данному риккетсиозу в прошлом стран Балканского полуострова, а также Ближнего и Среднего Востока, то возникавшие там в последние 30-40 лет войны, сопровождавшиеся миграцией населения из зон военных конфликтов, не были осложнены эпидемиями сыпного тифа. Действия советских войск в Афганистане (1979-1989), а также федеральных войск в Чеченской Республике (1994-1996) также не вызвали вспышек риккетсиозов, в том числе и сыпного тифа. Этот опыт подкрепляет уверенность в том, что принятая в России система санитарно-эпидемиологического надзора позволяет своевременно и эффективно предупреждать возможное распространение сыпнотифозного риккетсиоза.
Наиболее распространенным в России, но ограниченным только регионами Сибири и Дальнего Востока, является клещевой риккетсиоз Северной Азии. Его обязательная регистрация введена в 1979 г., и за последующие 16 лет было учтено 19328 случаев этой болезни с почти шестикратным возрастанием заболеваемости. В 1993-1994 гг. на Алтайский край приходилось 34% ежегодной заболеваемости, на Республику Алтай и Хакасию — 15%, Красноярский край — 11%,а остальные 40% заболеваемости — на 10 других административных территорий Сибири и Дальнего Востока, эндемичных по данному риккетсиозу. Наиболее высокая заболеваемость отмечалась в Республике Алтай — 54,9-65,4 на 100 тыс. населения и Алтайском крае — 21,6-38,8 при среднем для России уровне, равном 1,2-1,5. Эндемические активные очаги клещевого риккетсиоза обнаружены в последние годы в Тюменской и Курганской областях. Эпидемиологически значимыми переносчиками являются многочисленные виды инфицированных клещей рода Dermacentor, постоянно обитающие на обширных степных, лесостепных и горных пространствах Сибири и Дальнего Востока. В Алтайском крае их риккетсиоформность достигает, например, 1,7%, на юге Красноярского края — 2,75%. Заражение населения происходит преимущественно весной и летом в природных стациях клещей, что совпадает с периодом активности imago после зимней спячки. Увеличение в 2,7 раза заболеваемости клещевым риккетсиозом в последние 10 лет (с 821 до 2361 случаев) объясняется повышением контактов населения, особенно городского, с переносчиками в связи с хозяйственным освоением территорий, где существуют природные очаги возбудителя и сохраняется высокая численность клещей.
В результате трансформации природных очагов риккетсиозов под воздействием человека, например, при вырубке леса и кустарника, распашке лугов, прекращении выпаса животных, постепенно уменьшается численность клещей, соответственно и снижается заболеваемость. Процесс этот длится несколько лет. Именно по этой причине на эндемичных территориях отмечены природные очаги со «стабильной» из года в год заболеваемостью в зоне горных степей и лесостепей южных горных областей Сибири (Алтайский край и Горный Алтай). Медленное снижение заболеваемости вследствие ландшафтной трансформации территорий отмечено и в других регионах.
Общая картина эпидемиологических проявлений клещевого риккетсиоза за все годы наблюдений не изменилась. Она имеет рассеянный по территориям и времени характер изолированных друг от друга заболеваний. Своевременно и энергично проводимые противоклещевые мероприятия существенно влияют на заболеваемость.
Близкой по своим эколого-эпидемиологическим особенностям к R. sibirica, возбудителю клещевого риккетсиоза, является возбудитель лихорадки Ку — Coxiella burnetii. Он сохраняется и циркулирует на территории России в многочисленных природных очагах. Заболевания людей отмечены более чем на 50 административных территориях. Официально она регистрируется с 1957 г. С этого времени заболеваемость лихорадкой Ку возросла почти в 17 раз, с 0 до одного случая на 100 тыс. населения, благодаря в основном повышению знаний об этой инфекции и улучшению ее диагностики. Однако по прежнему распознавание коксиеллеза значительно затрудняется вследствие полиморфности клинического течения болезни. По отдаленным последствиям коксиеллез также опасен, как и бартонеллез, поскольку примерно у 10% нелеченных своевременно больных развивается эндокардит.
Экологическая особенность лихорадки Ку состоит в возникновении помимо природных очагов многочисленных ареалов возбудителя, связанных с хозяйственной деятельностью человека. В последние годы такие очаги, главным образом «козье-овечьего» типа, зарегистрированы не только в европейской, но и в азиатской части России: 32,4% заболевших в Астраханской области, 24,1% — в Новосибирской и 12,5% — в Воронежской. Заражения в основном возникают в периоды отела и окота сельскохозяйственных животных — в феврале-мае, что обусловливает повышение заболеваемости населения сельскохозяйственных районов. Известны многие случаи групповых заболеваний (до 100 человек), связанные с переработкой продуктов животноводства, в частности козьего пуха, или же с прогоном через населенные пункты заклещевленных овец с высокой инфицированностью переносчика коксиеллами.
Для лихорадки Ку наиболее распространенным путем передачи инфекции является аэрогенный. В литературе упоминаются заражения алиментарным путем через инфицированное молоко и мясопродукты, а также через укусы клещей. Исходя из эпидемиологии и экологических особенностей возбудителя коксиеллеза в его профилактике важное значение приобретают санитарно-ветеринарный контроль, в частности выбраковка больных животных из зараженных отар и животноводческих хозяйств, а также усиление роли санитарно-эпидемиологического надзора и эпизоотологического контроля за инфекцией.
Патологический процесс при риккетсиозах человека обуславливается тем, что риккетсии, за исключением С. burnetii (см. «Лихорадку Ку»), размножаются главным образом в эндотелиальных клетках, выстилающих стенки кровеносных сосудов, особенно мелких, где на месте их паразитирования образуются специфические для данной патологии микроскопически выявляемые образования — узелки (гранулемы). Подробнее материалы о патогенезе и патологической анатомии представлены для каждой нозологической формы в отдельности.
В клиническом отношении все риккетсиозы человека являются остро протекающими циклическими болезнями с выраженной интоксикацией, часто тифозным состоянием, характерным симптомокомплексом со стороны центральной нервной системы и сосудистого аппарата, наличием характерной экзантемы (кроме лихорадки Ку). При этом, однако, каждый риккетсиоз имеет свою достаточно типичную клиническую картину, что будет видно из описания соответствующих нозологических форм. При лихорадке Ку возможно и хроническое течение процесса.
Во время болезни и после нее при риккетсиозах создается обычно стойкий иммунитет. По данным П. Ф. Здродовского, он двупрофильный — антиинфекционный и антитоксический. Выявление в последние годы фактов длительного сохранения возбудителей риккетсиозов в организме человека и животных как в случаях естественной передачи, так и при экспериментальной инфекции позволяет многим исследователям говорить о так называемом нестерильном, т. е. инфекционном, иммунитете, в то время как другие отвергают такую возможность. Наблюдавшуюся повторную заболеваемость при некоторых риккетсиозах, в частности болезни Брилля, одни авторы рассматривают как новое заражение (экзогенная инфекция) при условии угасания иммунитета, а другие — как следствие активизации сохранившихся в организме возбудителей после первичной инфекции, но опять-таки при условии угасания иммунитета и снижения общей реактивности макроорганизма (эндогенная инфекция).
Выявление иммунологических свойств организма при риккетсиозах достигается в практической работе с помощью серологических реакций — реакций агглютинации с соответствующими риккетсиями, особенно реакции макроагглютинации по Вейглю, а также путем использования реакции гемагглютинации, реакции связывания комплемента, реакции нейтрализации токсического действия риккетсий, реакции кольцепреципитации, благодаря которым выявляются специфические антитела, и, наконец, с помощью аллергических проб. Указанные иммунологические тесты обычно и служат целям идентификации риккетсий и риккетсиозов.
Наряду с этим в настоящее время в качестве серологического теста используется реакция Вейля-Феликса, предложенная еще в 1916 г. Weil и Felix с использованием штаммов ОХ19 и ОХ2 Proteus vulgaris и штамма ОХК Proteus mirabilis, которые имеют в своем составе общий с риккетсиозами антиген (термостабильный глюцидо-липидный комплекс). Эта реакция групповая и выявляется почти при всех риккетсиозах человека, что позволяет дифференцировать их от других болезней. При некоторых же риккетсиозах реакция Вейля-Феликса всегда (лихорадка Ку) или почти всегда (везикулезный риккетсиоз) дает отрицательные результаты.
Наконец, в последние годы в целях возможно быстрого выявления и серологической идентификации риккетсий, причем не только жизнеспособных, но погибших и даже распавшихся, а также растворимого антигена используется люминесцентно-серологический метод исследования.
В настоящее время по предположению многих исследователей все риккетсиозы по их этиологической, иммунологической и эпидемиологической сущности, патогенезу и клинической картине болезни подразделяют на 6 групп. В табл. 1 дана общая характеристика их с представлением ряда общих сведений по отдельным нозологическим формам.