Общая характеристика риккетсий и риккетсиозов
Лабораторная диагностика риккетсиозов
Клиническая диагностика риккетсиозов, бартонеллезов, эрлихиозов, коксиеллеза в начальной стадии без знания эпидемиологических обстоятельств болезни затруднена. Это обусловлено чаще всего отсутствием патогномоничных признаков болезни, спорадичностью многих риккетсиозов или их неожиданным появлением в нехарактерных для них регионах, а также бесспорным существованием атипичных, клинически стертых случаев. Данные обстоятельства приводят к ретроспективной диагностике многих нозоформ риккетсиозов, особенно лихорадки Ку и, как следствие, к запаздыванию специфического лечения. Как и все методы, используемые в таком случае, она включает методы выявления (выделения) возбудителя и методы определения специфических антител.
Таблица 5.
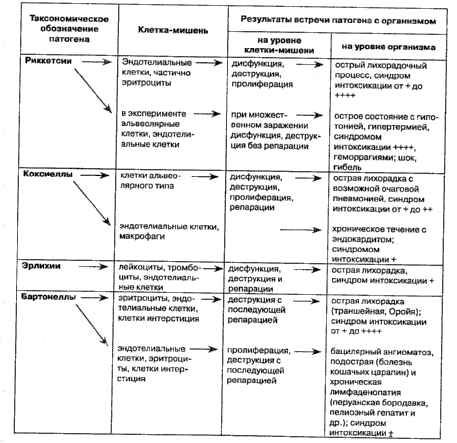
Общая схема взаимодействия патогенных для человека организмов порядка Риккетсиалес и семейства Бартонеллацеае
Обнаружение возбудителя и получение его культуры для подтверждения этиологии болезни с большим успехом проводится до лечения антибиотиками. С этой целью используют лабораторных животных (морских свинок, белых и хлопковых крыс, хомячков), куриные эмбрионы и клеточные культуры. Животным и куриным-эмбрионам вводят дефибринированную кровь или растертые сгустки крови, биопсийный материал из специфических поражений кожи, а также других тканей больного в зависимости от подозрения на ту или иную форму болезни.
При заражении клеточных культур применяют плазму или гепаринизированную кровь и различный биопсийный материал. В недалеком прошлом выделение возбудителя сыпного тифа и окопной (волынской) лихорадки осуществляли методом ксенодиагностики, то есть путем кормления платяных вшей на больном или же их инфицирования кровью больных через искусственную мембрану. С этой целью использовали также линию вшей, адаптированную к питанию на кроликах.
Для быстрого подтверждения специфичности болезни неоднократно использовали иммуногистологическое изучение биоптатов из кожных высыпаний, первичного аффекта при клещевых пятнистых лихорадках, лимфатических узлов при болезни кошачьих царапин или секционного материала из удаленных клапанов сердца при коксиеллезом эндокардите, аспирационного материала костного мозга или печени при подозрении на лихорадку Ку или бартонеллез. Иммуноцитохимическому анализу в таких случаях можно подвергать не только «свежий» биоптат, но и материал, фиксированный формалином и залитый в парафин. Затем возбудитель выявляют методом иммунофлуоресцентного или пероксидазного окрашивания специфическими сыворотками. Недавно была успешно использована методика выявления специфическими моноклональными антителами риккетсий на эндотелиальных клетках, свободно циркулирующих в кровяном русле больного.
В ряде ситуаций, когда неясны эпидемиологическая и экологическая характеристики лихорадочного заболевания и имеет место вспышка болезни, целесообразно выделять возбудитель не только от больного, но и из предполагаемых переносчиков (клещи, вши, животные), предположительно обсемененного микроорганизмом ближайшего окружения больного или из возможного источника-резервуара возбудителя (грызунов, домашних животных).
Все вышеперечисленные методы выделения и последующей идентификации возбудителя доступны лишь специализированным лабораториям и в большинстве случаев не могут быть использованы с диагностической целью в повседневной клинической практике из-за отсутствия безопасных условий, подготовленного персонала и навыков работы с возбудителями П-Ш групп патогенности.
В связи с вышеизложенными основными методами первичной идентификации возбудителя и дифференциальной диагностики заболевания по-прежнему остаются сероиммунологические методы. Исторически серологическая диагностика риккетсиозов ведет свое начало с момента обнаружения Weil и Felix феномена агглютинации микроорганизмов из рода Proteus с сыворотками больных сыпным тифом. Реакция агглютинации с Proteus OX19 неизменно подтверждала . эпидемический сыпной тиф, но была непостоянной, обычно отрицательной, с сыворотками больных его рецидивной формой (болезнью Брилля), что зависело отчасти от интервала между первичным заболеванием и рецидивом. Данный вид протея обеспечивает положительные результаты в определенном проценте случаев и при исследовании сывороток от больных с клещевыми пятнистыми лихорадками (КПЛ ). К сожалению, по мере совершенствования методов культивирования риккетсий и выпуска коммерчески доступных диагностикумов реакция Вейль-Феликса была необоснованно исключена в России из практики.
Некоторые представители рода Proteus были использованы для диагностики других риккетсиозов, например, лихорадка цуцугамуши успешно подтверждается с диагностикумом из Proteus OXk. В 90-е годы вновь появились работы в «защиту» данных диагностикумов. На основании сопоставления результатов реакции протеем ОХк и антигеном из ориенций (до 1995 г. — риккетсий) цуцугамуши в реакции иммуно-флуоресценции (метод ИФА) и в иммуноблоте, авторы пришли к выводу о том, что положительные результаты агглютинации обусловлены со стороны протея ОХк его липополисахаридами (ЛПС), а со стороны ориенций цуцугамуши пока еще неизвестным комплексом антигенов, но не ЛПС, поскольку последние отсутствуют у ориенций. В связи с этим были начаты поиски антигенных детерминат Л ПС, общих для другого протея (ОХ2) и риккетсий КПЛ. Установлена идентичность химического состава О-полисахарида ЛПС возбудителей сыпного и крысиного тифов и протея ОХ19. Считается, что именно эти структуры обеспечивают положительные результаты реакций Вейль- Феликса.
Очевидно, что диагностикум на основе специфических детерминант, полученных из невирулентного, легко культивируемого микроорганизма, к которым относятся различные виды рода Proteus, более перспективен для клинических лабораторий, чем препараты, предназначенные для более сложных, хотя и специфических реакций.
По мере развития способов культивирования различных видов рассматриваемого класса микроорганизмов в лабораторную практику поступали новые диагностикумы на основе специфических антигенов различной степени дисперсности из указанных микроорганизмов. В частности, широкое распространение получила реакция агглютинации; (РА) для подтверждения сыпнотифозной инфекции. Реакция включает два компонента: взвесь (корпускулы) риккетсий и испытуемую сыворотку.
Постановка реакции занимает мало времени, может выполняться в модификациях и ставиться в пробирках, на планшетах или на предметных стеклах в виде капли. Выпуск корпускулярных антигенов для диагностики эпидемического и эндемического (крысиного) тифа в РА, а также выявление лихорадки Ку и окопной лихорадки был освоен производственными лабораториями. В связи с низким накоплением других видов возбудителей этот вид диагностикума не производился для обнаружения КПЛ, лихорадки цуцугамуши и эрлихиозов.
После 1944 г., с момента открытия серологической активности антигенной фракции риккетсий Провачека, диагностика риккетсиозов стала более доступной. Основным методом выявления специфических антител у больных, в том числе лихорадкой цуцугамуши, Ку и окопной лихорадкой стала реакция связывания комплемента (РСК) в различных модификациях. Во всех современных антигенных препаратах для РСК, кроме предназначенных для диагностики коксиелл и бартонелл квинтана, содержащих взвесь корпускул возбудителя, заложены растворимые фракции соответствующих микроорганизмов. Следует заметить, что высокая специфичность и четкость получаемых результатов при использовании в РСК растворимых антигенов, не обеспечивает дифференциацию болезней внутри группы сыпного тифа и группы КПЛ. Для целей дифференции с помощью РСК необходимо применение корпускулярных антигенов, но они менее доступны для практического применения в штатных лабораториях, вследствие сложности приготовления и высокой коммерческой стоимости.
Несколько позднее РСК была разработана и внедрена в практику реакция непрямой гемагглютинации (РНГА). В реакции участвует комплекс Л ПС и белковых антигенов. В нашей стране эта реакция нашла широкое применение в диагностике сыпного тифа как в макро- так и микровариантах, пробирочной постановке и на планшетах. Реакция проста в выполнении и высокоспецифична.
Модификация РНГА с добавлением комплемента (РНГ), наоборот, не получила достаточного распространения, хотя ее возможности определения специфических антител больше таковых, чем у РНГА. Латексагглютинация, по сути, является аналогом РНГА, где тот же антиген предварительно фиксируется на бусинках латекса.
К категории непрямых реакций гемагглютинации относятся также и методики, в которых участвуют антигены риккетсий, фиксированные на носителях-эритроцитах барана, дополнительно обработанные таннином. Изменения в составе антигенных детерминант на примере химической сыпнотифозной вакцины, вместо обычного коммерческого антигена риккетсий Провачека, резко повысило чувствительность реакции как по титрам антител, так и срокам их выявления в крови реконвалесцентов. Однако неизбежное при этом повышение стоимости каждого исследования образцов сывороток не позволило использовать такую модификацию в практике диагностических лабораторий.
В 70-е годы для серологической диагностики риккетсиозов был предложен метод на основе флуоресцирующих антител (МФА). В настоящее время он является наиболее распространенным и стандартным методом подтверждения риккетсиозов и близкородственных к ним инфекций. Определение специфических антител в непрямом МФА (РНИФ) проводится с применением корпускулярных антигенов с введением в реакцию меченных флуорохромом иммуноглобулинов или их Fab-фрагментов антивидовых сывороток по отношению к испытуемым. Для тестирования возбудителя используют маркированные флуоресцеин-5-изотиоцианатом (ФИТЦ) специфические антитела — в прямой МФА или РИФ. Результаты определения регистрируют путем исследования препаратов в люминесцентном микроскопе. Метод достаточно специфичен, требует небольших затрат времени, экономичен.
Однако некоторый субъективизм в регистрации результатов требует от работающих определенного опыта при учете результатов постановки этой реакции.
Помимо метода РНИФ, в настоящее время получил распространение метод иммуноферментного анализа (ИФА), известный также как метод энзиммеченных антител (ELISA). Он используется в различных вариантах для идентификации возбудителя, его антигенов и определения специфических антител. Регистрация результатов возможна инструментальной (спектрофотометр) или визуальной оценкой. Преимуществом ИФА в определении антител является возможность использования в качестве антигена как растворимых, так и корпускулярных фракций возбудителей.
Применение последних двух реакций открыло возможность не только определять специфические антитела, но и анализировать состав иммуноглобулиновых фракций, что создает им большие преимущества по сравнению с другими методами.
Следует отметить, что, несмотря на многолетнюю историю диагностики риккетсиозов и близких к ним болезней на основе специфических антител, постоянное совершенствование существующих и введение новых методов их выявления, положительные результаты определения антител у большинства больных возможно получить лишь на второй неделе болезни. Это определяется особенностями антительного ответа на возбудитель в организме заболевших. В первые 5-7 дней после появления признаков болезни специфические антитела в низких титрах (1:10 - 1:40 в РСК, 1:20 - 1:80 в РНИФ, 1:500 -1:1000 в ИФА) определяются лишь у 20-40% больных. В последующем, в отсутствие лечения антибиотиками, титры антител растут, достигая максимума на 15-30 дни с момента появления клинических симптомов. При этиотропной терапии антибиотиками широкого спектра действия количество антител либо не возрастает, либо пик их содержания в крови запаздывает во времени и может быть обнаружен лишь после прекращения антибиотикотерапии. Обычно уровень антител в стадии поздней реконвалесценции постепенно снижается; к первому году наблюдения от начала болезни по некоторым серологическим тестам они не выявляются. Динамика количественных характеристик различных антител неоднозначна, а ее получение зависит от состава введенного в диагностикум антигена.
Исключение составляет лихорадка Ку вследствие особенностей патогенеза и разнообразия клинического проявления этой инфекции. Именно поэтому клиническая диагностика лихорадки Ку (коксиеллеза) представляет значительные трудности. Инфекционный процесс при коксиеллезе лежит в границах от бессимптомного течения, четко очерченной острой болезни с высокой температурой до вялотекущих хронических форм с поражением печени, многомесячным астеническим синдромом и различными осложнениями, включая коксиеллезный эндокардит с неблагоприятным прогнозом. Лабораторная диагностика и в особенности серологическая, при этой инфекции играет решающую роль. Известно, что возбудитель лихорадки Ку — коксиелла Бернета имеет более сложную антигенную структуру, связанную с фазовым состоянием возбудителя. Поэтому для диагностики коксиеллеза необходимо применять антигены, полученные из возбудителя, находящегося в I, II и переходной (1-П) фазах, вне зависимости от используемого серологического метода исследования сыворотки (РСК, РНИФ, ИФА). Только в этом случае возможно обнаружение специфических антител, характеризующих острую или хроническую форму коксиеллеза, оценка эффективности лечения и прогноз исхода болезни.
Первичная диагностика коксиеллеза основана на применении антигена коксиелл в фазе II. К этому комплексу антигенных структур возбудителя формируются специфические антитела в начале развития болезни, и они же выявляются во все периоды его течения. Диагноз ставится на основании четырехкратного прироста или снижения титра антител в парных сыворотках, взятых с интервалом в 10-12 дней. При однократном определении специфических антител диагностическими титрами являются > 1:64 при определении в РСК, > 1:200 - в РНИФ, > 1:1000 - в ИФА. Приведенные значения титров относятся к определению суммарных иммуноглобулинов с антигеном фазы II коксиелл. Практически эти же значения титров выявляются и при определении IgG-антител, поскольку этот класс иммуноглобулинов составляет 60-75% от их общего количества.
IgM —антитела с антигеном в фазе II также можно уловить в период острой инфекции. Титры этих иммуноглобулинов будут низкими, порядка > 1:50, при определении в РНИФ. После выздоровления специфические антитела IgG класса к антигену коксиелл II фазы сохраняются в течение многих лет.
Что же касается антител, определяемых антигенами коксиелл фазы I, то они доступны для выявления лишь с 3-4 недели болезни; их уровень и длительность циркуляции в крови больных зависят от течения коксиеллеза. В период выздоровления титры их значительно снижаются и через 2-3 месяца они исчезают. В случае перехода инфекции в хроническую форму, антитела к антигену фазы I сохраняются на высоком уровне и длительно персистируют в организме больного. Выявление IgG антител к антигену I фазы коксиелл в титре 1:800 в РНИФ рассматривается как прямое доказательство хронической лихорадки Ку. При постановке менее чувствительной реакции (РСК) с антигеном I фазы диагностическим титром для хронической формы лихорадки Ку считается величина титров > 1:128.
Важную диагностическую информацию при коксиеллезе несут специфические антитела класса IgA. Этот класс иммуноглобулинов составляет 10-15% от их общего количества. Они находятся главным образом в экстраваскулярных жидкостях: слюне, слезах, носовой слизи, желудочном соке. При активной острой форме коксиеллеза данные антитела определяются в титрах > 1:50 преимущественно с антигенами фазы I—II или II. Высокие титры (> 1:400) антител класса IgA к антигену фазы I служат несомненным свидетельством хронической формы инфекции.
В последние годы появились также доказательства значимости отдельных субклассов иммуноглобулинов при коксиеллезе. Динамика изменений в составе отдельных субклассов иммуноглобулинов, как это теперь стало известно, сигнализирует о тяжести инфекционного процесса, результатах лечения и прогнозе исхода болезни. Для острой формы характерно наличие субклассов IgGl и IgG3 и отсутствие IgG2 субкласса при использовании всех фазовых антигенов, а также синтез преимущественно субкласов IgAl к антигенам в фазе I и I—II коксиелл. Наибольший набор субклассов иммуноглобулинов отмечается при хронических формах. Для них определяются иммуноглобулины IgGl, IgG2, IgG3 с антигенами всех фазовых состояний коксиелл. Далее, осложнение коксиеллеза эндокардитом сопровождается появлением IgA2 к антигену фазы II. Такое сочетание не установлено ни при какой другой форме коксиеллеза. Следовательно, субклассы иммуноглобулинов играют определяющее диагностическое значение. Отсутствие IgA2 сигнализирует об острой форме инфекции, тогда как появление IgA2 к антигену фазы II определяет коксиеллезный эндокардит у больного.
Следует отметить, что в группе сыпного тифа, КПЛ и эрлихиозов существуют значительные перекрестные реакции, обусловленные общностью антигенных структур возбудителей внутри групп. Это затрудняет серодиагностику конкретной нозоформы. Именно поэтому ни одна из существующих используемых модификаций серологических реакций (РСК, РНИФ, РНГА, ИФА) не обеспечивает четкие дифференцирующие ответы. Разброс в титрах антител у индивидуальных больных при применении антигенов соответствующих возбудителей, принадлежащих к данным группам, настолько велик, что по их уровню невозможно достоверно разделить заболевания по нозоформам. Для этого необходимо привлекать данные клиники и эпидемиологического обследования. Вместе с тем, антигенные совпадения у видов риккетсий внутри групп, особенно КПЛ и эрлихиозов, создает и некоторый положительный момент, поскольку любой диагностикум из этой группы может быть использован для первичного определения риккетсиоза в пределах группы.
В заключение следует отметить, что современная диагностика и окончательная расшифровка этиологической принадлежности рассматриваемой группы инфекций, а также сероэпидемиологические исследования в эндемичных очагах риккетсиозов были бы невозможны без привлечения техники моноклональных антител (МКА) и других современных методик, таких как иммуноблоттинг и полимеразная цепная реакция (ПЦР). Последнее стало возможным благодаря стремительному развитию молекулярно-биологических методов исследования в 80-90-е годы, что привело к созданию технологии амплификации нуклеиновых кислот в виде ПЦР. Данная реакция, благодаря относительно простому приборному оформлению, позволяет осуществить точную и быструю (в течение нескольких часов) идентификацию возбудителя в различных субстратах от больного с очень высокой чувствительностью, порядка 30 риккетсий в пробе.
Сущность реакции состоит в количественном увеличении генетического материала, присутствующего в пробе, с последующей его расшифровкой по известным компонентам (праймерам), вводимым в реакцию. В настоящее время ПЦР широко используют для классификации микроорганизмов на основе выявления сходства и различий в построении генома, а также в клинической практике. Достоинством реакции является возможность исследовать не только материал, содержащий живого возбудителя, но и погибшие или же фрагменты его ДНК. Накопление результатов применения ПЦР к настоящему времени позволило создать наборы праймеров для идентификации всех представителей риккетсиозов, бартонеллеза, эрлихиозов и коксиеллеза. В отношении возбудителей рода Rickettsia применяют праймеры, синтезированные на основе фрагментов гена цитрат синтазы риккетсий Провачека, генов 17 кДА, 120 и 190 белков риккетсий Риккетса. Введение в ПЦР праймеров гена 16Sr RNA впервые представило возможность индикации широкого круга возбудителей и их выявления в сложных, неясных случаях заболеваний. При поисках возбудителя болезни кошачьих царапин, Bartonella henselae, а также других бартонеллезов и эрлихиозов в ПЦР были введены праймеры гена цитрат синтазы. Праймеры генов 16SrRNA, а также 56кДА белкового антигена, используют для идентификации возбудителя лихорадки цуцугамуши. Род коксиелла тестируют праймерами на основе гена 23г ДНК. Поскольку специфические видовые праймеры для родов Rickettsia, Orienta, Bartonella и Coxiella в настоящее время отсутствуют, полученные в ПЦР фрагменты нуклеиновых кислот подвергают дополнительному рестрикционному анализу для дифференциации видов.
Из вышеизложенного очевидно, что полная клиническая диагностика рассматриваемой группы инфекций с определением таксономической принадлежности отдельных ее возбудителей невозможна без привлечения современных серологических и молекулярно-генетических методов исследования. Это положение подтвердилось при расшифровке этиологии так называемой «Астраханской лихорадки», заболеваний, связанных с бартонеллезами и эрлихиозами, и особенно, при определении распространения и выяснении природы отдаленных осложнений коксиеллеза.
Клиническая диагностика риккетсиозов, бартонеллезов, эрлихиозов, коксиеллеза в начальной стадии без знания эпидемиологических обстоятельств болезни затруднена. Это обусловлено чаще всего отсутствием патогномоничных признаков болезни, спорадичностью многих риккетсиозов или их неожиданным появлением в нехарактерных для них регионах, а также бесспорным существованием атипичных, клинически стертых случаев. Данные обстоятельства приводят к ретроспективной диагностике многих нозоформ риккетсиозов, особенно лихорадки Ку и, как следствие, к запаздыванию специфического лечения. Как и все методы, используемые в таком случае, она включает методы выявления (выделения) возбудителя и методы определения специфических антител.
Таблица 5.
Общая схема взаимодействия патогенных для человека организмов порядка Риккетсиалес и семейства Бартонеллацеае

Обнаружение возбудителя и получение его культуры для подтверждения этиологии болезни с большим успехом проводится до лечения антибиотиками. С этой целью используют лабораторных животных (морских свинок, белых и хлопковых крыс, хомячков), куриные эмбрионы и клеточные культуры. Животным и куриным-эмбрионам вводят дефибринированную кровь или растертые сгустки крови, биопсийный материал из специфических поражений кожи, а также других тканей больного в зависимости от подозрения на ту или иную форму болезни.
При заражении клеточных культур применяют плазму или гепаринизированную кровь и различный биопсийный материал. В недалеком прошлом выделение возбудителя сыпного тифа и окопной (волынской) лихорадки осуществляли методом ксенодиагностики, то есть путем кормления платяных вшей на больном или же их инфицирования кровью больных через искусственную мембрану. С этой целью использовали также линию вшей, адаптированную к питанию на кроликах.
Для быстрого подтверждения специфичности болезни неоднократно использовали иммуногистологическое изучение биоптатов из кожных высыпаний, первичного аффекта при клещевых пятнистых лихорадках, лимфатических узлов при болезни кошачьих царапин или секционного материала из удаленных клапанов сердца при коксиеллезом эндокардите, аспирационного материала костного мозга или печени при подозрении на лихорадку Ку или бартонеллез. Иммуноцитохимическому анализу в таких случаях можно подвергать не только «свежий» биоптат, но и материал, фиксированный формалином и залитый в парафин. Затем возбудитель выявляют методом иммунофлуоресцентного или пероксидазного окрашивания специфическими сыворотками. Недавно была успешно использована методика выявления специфическими моноклональными антителами риккетсий на эндотелиальных клетках, свободно циркулирующих в кровяном русле больного.
В ряде ситуаций, когда неясны эпидемиологическая и экологическая характеристики лихорадочного заболевания и имеет место вспышка болезни, целесообразно выделять возбудитель не только от больного, но и из предполагаемых переносчиков (клещи, вши, животные), предположительно обсемененного микроорганизмом ближайшего окружения больного или из возможного источника-резервуара возбудителя (грызунов, домашних животных).
Все вышеперечисленные методы выделения и последующей идентификации возбудителя доступны лишь специализированным лабораториям и в большинстве случаев не могут быть использованы с диагностической целью в повседневной клинической практике из-за отсутствия безопасных условий, подготовленного персонала и навыков работы с возбудителями П-Ш групп патогенности.
В связи с вышеизложенными основными методами первичной идентификации возбудителя и дифференциальной диагностики заболевания по-прежнему остаются сероиммунологические методы. Исторически серологическая диагностика риккетсиозов ведет свое начало с момента обнаружения Weil и Felix феномена агглютинации микроорганизмов из рода Proteus с сыворотками больных сыпным тифом. Реакция агглютинации с Proteus OX19 неизменно подтверждала . эпидемический сыпной тиф, но была непостоянной, обычно отрицательной, с сыворотками больных его рецидивной формой (болезнью Брилля), что зависело отчасти от интервала между первичным заболеванием и рецидивом. Данный вид протея обеспечивает положительные результаты в определенном проценте случаев и при исследовании сывороток от больных с клещевыми пятнистыми лихорадками (КПЛ ). К сожалению, по мере совершенствования методов культивирования риккетсий и выпуска коммерчески доступных диагностикумов реакция Вейль-Феликса была необоснованно исключена в России из практики.
Некоторые представители рода Proteus были использованы для диагностики других риккетсиозов, например, лихорадка цуцугамуши успешно подтверждается с диагностикумом из Proteus OXk. В 90-е годы вновь появились работы в «защиту» данных диагностикумов. На основании сопоставления результатов реакции протеем ОХк и антигеном из ориенций (до 1995 г. — риккетсий) цуцугамуши в реакции иммуно-флуоресценции (метод ИФА) и в иммуноблоте, авторы пришли к выводу о том, что положительные результаты агглютинации обусловлены со стороны протея ОХк его липополисахаридами (ЛПС), а со стороны ориенций цуцугамуши пока еще неизвестным комплексом антигенов, но не ЛПС, поскольку последние отсутствуют у ориенций. В связи с этим были начаты поиски антигенных детерминат Л ПС, общих для другого протея (ОХ2) и риккетсий КПЛ. Установлена идентичность химического состава О-полисахарида ЛПС возбудителей сыпного и крысиного тифов и протея ОХ19. Считается, что именно эти структуры обеспечивают положительные результаты реакций Вейль- Феликса.
Очевидно, что диагностикум на основе специфических детерминант, полученных из невирулентного, легко культивируемого микроорганизма, к которым относятся различные виды рода Proteus, более перспективен для клинических лабораторий, чем препараты, предназначенные для более сложных, хотя и специфических реакций.
По мере развития способов культивирования различных видов рассматриваемого класса микроорганизмов в лабораторную практику поступали новые диагностикумы на основе специфических антигенов различной степени дисперсности из указанных микроорганизмов. В частности, широкое распространение получила реакция агглютинации; (РА) для подтверждения сыпнотифозной инфекции. Реакция включает два компонента: взвесь (корпускулы) риккетсий и испытуемую сыворотку.
Постановка реакции занимает мало времени, может выполняться в модификациях и ставиться в пробирках, на планшетах или на предметных стеклах в виде капли. Выпуск корпускулярных антигенов для диагностики эпидемического и эндемического (крысиного) тифа в РА, а также выявление лихорадки Ку и окопной лихорадки был освоен производственными лабораториями. В связи с низким накоплением других видов возбудителей этот вид диагностикума не производился для обнаружения КПЛ, лихорадки цуцугамуши и эрлихиозов.
После 1944 г., с момента открытия серологической активности антигенной фракции риккетсий Провачека, диагностика риккетсиозов стала более доступной. Основным методом выявления специфических антител у больных, в том числе лихорадкой цуцугамуши, Ку и окопной лихорадкой стала реакция связывания комплемента (РСК) в различных модификациях. Во всех современных антигенных препаратах для РСК, кроме предназначенных для диагностики коксиелл и бартонелл квинтана, содержащих взвесь корпускул возбудителя, заложены растворимые фракции соответствующих микроорганизмов. Следует заметить, что высокая специфичность и четкость получаемых результатов при использовании в РСК растворимых антигенов, не обеспечивает дифференциацию болезней внутри группы сыпного тифа и группы КПЛ. Для целей дифференции с помощью РСК необходимо применение корпускулярных антигенов, но они менее доступны для практического применения в штатных лабораториях, вследствие сложности приготовления и высокой коммерческой стоимости.
Несколько позднее РСК была разработана и внедрена в практику реакция непрямой гемагглютинации (РНГА). В реакции участвует комплекс Л ПС и белковых антигенов. В нашей стране эта реакция нашла широкое применение в диагностике сыпного тифа как в макро- так и микровариантах, пробирочной постановке и на планшетах. Реакция проста в выполнении и высокоспецифична.
Модификация РНГА с добавлением комплемента (РНГ), наоборот, не получила достаточного распространения, хотя ее возможности определения специфических антител больше таковых, чем у РНГА. Латексагглютинация, по сути, является аналогом РНГА, где тот же антиген предварительно фиксируется на бусинках латекса.
К категории непрямых реакций гемагглютинации относятся также и методики, в которых участвуют антигены риккетсий, фиксированные на носителях-эритроцитах барана, дополнительно обработанные таннином. Изменения в составе антигенных детерминант на примере химической сыпнотифозной вакцины, вместо обычного коммерческого антигена риккетсий Провачека, резко повысило чувствительность реакции как по титрам антител, так и срокам их выявления в крови реконвалесцентов. Однако неизбежное при этом повышение стоимости каждого исследования образцов сывороток не позволило использовать такую модификацию в практике диагностических лабораторий.
В 70-е годы для серологической диагностики риккетсиозов был предложен метод на основе флуоресцирующих антител (МФА). В настоящее время он является наиболее распространенным и стандартным методом подтверждения риккетсиозов и близкородственных к ним инфекций. Определение специфических антител в непрямом МФА (РНИФ) проводится с применением корпускулярных антигенов с введением в реакцию меченных флуорохромом иммуноглобулинов или их Fab-фрагментов антивидовых сывороток по отношению к испытуемым. Для тестирования возбудителя используют маркированные флуоресцеин-5-изотиоцианатом (ФИТЦ) специфические антитела — в прямой МФА или РИФ. Результаты определения регистрируют путем исследования препаратов в люминесцентном микроскопе. Метод достаточно специфичен, требует небольших затрат времени, экономичен.
Однако некоторый субъективизм в регистрации результатов требует от работающих определенного опыта при учете результатов постановки этой реакции.
Помимо метода РНИФ, в настоящее время получил распространение метод иммуноферментного анализа (ИФА), известный также как метод энзиммеченных антител (ELISA). Он используется в различных вариантах для идентификации возбудителя, его антигенов и определения специфических антител. Регистрация результатов возможна инструментальной (спектрофотометр) или визуальной оценкой. Преимуществом ИФА в определении антител является возможность использования в качестве антигена как растворимых, так и корпускулярных фракций возбудителей.
Применение последних двух реакций открыло возможность не только определять специфические антитела, но и анализировать состав иммуноглобулиновых фракций, что создает им большие преимущества по сравнению с другими методами.
Следует отметить, что, несмотря на многолетнюю историю диагностики риккетсиозов и близких к ним болезней на основе специфических антител, постоянное совершенствование существующих и введение новых методов их выявления, положительные результаты определения антител у большинства больных возможно получить лишь на второй неделе болезни. Это определяется особенностями антительного ответа на возбудитель в организме заболевших. В первые 5-7 дней после появления признаков болезни специфические антитела в низких титрах (1:10 - 1:40 в РСК, 1:20 - 1:80 в РНИФ, 1:500 -1:1000 в ИФА) определяются лишь у 20-40% больных. В последующем, в отсутствие лечения антибиотиками, титры антител растут, достигая максимума на 15-30 дни с момента появления клинических симптомов. При этиотропной терапии антибиотиками широкого спектра действия количество антител либо не возрастает, либо пик их содержания в крови запаздывает во времени и может быть обнаружен лишь после прекращения антибиотикотерапии. Обычно уровень антител в стадии поздней реконвалесценции постепенно снижается; к первому году наблюдения от начала болезни по некоторым серологическим тестам они не выявляются. Динамика количественных характеристик различных антител неоднозначна, а ее получение зависит от состава введенного в диагностикум антигена.
Исключение составляет лихорадка Ку вследствие особенностей патогенеза и разнообразия клинического проявления этой инфекции. Именно поэтому клиническая диагностика лихорадки Ку (коксиеллеза) представляет значительные трудности. Инфекционный процесс при коксиеллезе лежит в границах от бессимптомного течения, четко очерченной острой болезни с высокой температурой до вялотекущих хронических форм с поражением печени, многомесячным астеническим синдромом и различными осложнениями, включая коксиеллезный эндокардит с неблагоприятным прогнозом. Лабораторная диагностика и в особенности серологическая, при этой инфекции играет решающую роль. Известно, что возбудитель лихорадки Ку — коксиелла Бернета имеет более сложную антигенную структуру, связанную с фазовым состоянием возбудителя. Поэтому для диагностики коксиеллеза необходимо применять антигены, полученные из возбудителя, находящегося в I, II и переходной (1-П) фазах, вне зависимости от используемого серологического метода исследования сыворотки (РСК, РНИФ, ИФА). Только в этом случае возможно обнаружение специфических антител, характеризующих острую или хроническую форму коксиеллеза, оценка эффективности лечения и прогноз исхода болезни.
Первичная диагностика коксиеллеза основана на применении антигена коксиелл в фазе II. К этому комплексу антигенных структур возбудителя формируются специфические антитела в начале развития болезни, и они же выявляются во все периоды его течения. Диагноз ставится на основании четырехкратного прироста или снижения титра антител в парных сыворотках, взятых с интервалом в 10-12 дней. При однократном определении специфических антител диагностическими титрами являются > 1:64 при определении в РСК, > 1:200 - в РНИФ, > 1:1000 - в ИФА. Приведенные значения титров относятся к определению суммарных иммуноглобулинов с антигеном фазы II коксиелл. Практически эти же значения титров выявляются и при определении IgG-антител, поскольку этот класс иммуноглобулинов составляет 60-75% от их общего количества.
IgM —антитела с антигеном в фазе II также можно уловить в период острой инфекции. Титры этих иммуноглобулинов будут низкими, порядка > 1:50, при определении в РНИФ. После выздоровления специфические антитела IgG класса к антигену коксиелл II фазы сохраняются в течение многих лет.
Что же касается антител, определяемых антигенами коксиелл фазы I, то они доступны для выявления лишь с 3-4 недели болезни; их уровень и длительность циркуляции в крови больных зависят от течения коксиеллеза. В период выздоровления титры их значительно снижаются и через 2-3 месяца они исчезают. В случае перехода инфекции в хроническую форму, антитела к антигену фазы I сохраняются на высоком уровне и длительно персистируют в организме больного. Выявление IgG антител к антигену I фазы коксиелл в титре 1:800 в РНИФ рассматривается как прямое доказательство хронической лихорадки Ку. При постановке менее чувствительной реакции (РСК) с антигеном I фазы диагностическим титром для хронической формы лихорадки Ку считается величина титров > 1:128.
Важную диагностическую информацию при коксиеллезе несут специфические антитела класса IgA. Этот класс иммуноглобулинов составляет 10-15% от их общего количества. Они находятся главным образом в экстраваскулярных жидкостях: слюне, слезах, носовой слизи, желудочном соке. При активной острой форме коксиеллеза данные антитела определяются в титрах > 1:50 преимущественно с антигенами фазы I—II или II. Высокие титры (> 1:400) антител класса IgA к антигену фазы I служат несомненным свидетельством хронической формы инфекции.
В последние годы появились также доказательства значимости отдельных субклассов иммуноглобулинов при коксиеллезе. Динамика изменений в составе отдельных субклассов иммуноглобулинов, как это теперь стало известно, сигнализирует о тяжести инфекционного процесса, результатах лечения и прогнозе исхода болезни. Для острой формы характерно наличие субклассов IgGl и IgG3 и отсутствие IgG2 субкласса при использовании всех фазовых антигенов, а также синтез преимущественно субкласов IgAl к антигенам в фазе I и I—II коксиелл. Наибольший набор субклассов иммуноглобулинов отмечается при хронических формах. Для них определяются иммуноглобулины IgGl, IgG2, IgG3 с антигенами всех фазовых состояний коксиелл. Далее, осложнение коксиеллеза эндокардитом сопровождается появлением IgA2 к антигену фазы II. Такое сочетание не установлено ни при какой другой форме коксиеллеза. Следовательно, субклассы иммуноглобулинов играют определяющее диагностическое значение. Отсутствие IgA2 сигнализирует об острой форме инфекции, тогда как появление IgA2 к антигену фазы II определяет коксиеллезный эндокардит у больного.
Следует отметить, что в группе сыпного тифа, КПЛ и эрлихиозов существуют значительные перекрестные реакции, обусловленные общностью антигенных структур возбудителей внутри групп. Это затрудняет серодиагностику конкретной нозоформы. Именно поэтому ни одна из существующих используемых модификаций серологических реакций (РСК, РНИФ, РНГА, ИФА) не обеспечивает четкие дифференцирующие ответы. Разброс в титрах антител у индивидуальных больных при применении антигенов соответствующих возбудителей, принадлежащих к данным группам, настолько велик, что по их уровню невозможно достоверно разделить заболевания по нозоформам. Для этого необходимо привлекать данные клиники и эпидемиологического обследования. Вместе с тем, антигенные совпадения у видов риккетсий внутри групп, особенно КПЛ и эрлихиозов, создает и некоторый положительный момент, поскольку любой диагностикум из этой группы может быть использован для первичного определения риккетсиоза в пределах группы.
В заключение следует отметить, что современная диагностика и окончательная расшифровка этиологической принадлежности рассматриваемой группы инфекций, а также сероэпидемиологические исследования в эндемичных очагах риккетсиозов были бы невозможны без привлечения техники моноклональных антител (МКА) и других современных методик, таких как иммуноблоттинг и полимеразная цепная реакция (ПЦР). Последнее стало возможным благодаря стремительному развитию молекулярно-биологических методов исследования в 80-90-е годы, что привело к созданию технологии амплификации нуклеиновых кислот в виде ПЦР. Данная реакция, благодаря относительно простому приборному оформлению, позволяет осуществить точную и быструю (в течение нескольких часов) идентификацию возбудителя в различных субстратах от больного с очень высокой чувствительностью, порядка 30 риккетсий в пробе.
Сущность реакции состоит в количественном увеличении генетического материала, присутствующего в пробе, с последующей его расшифровкой по известным компонентам (праймерам), вводимым в реакцию. В настоящее время ПЦР широко используют для классификации микроорганизмов на основе выявления сходства и различий в построении генома, а также в клинической практике. Достоинством реакции является возможность исследовать не только материал, содержащий живого возбудителя, но и погибшие или же фрагменты его ДНК. Накопление результатов применения ПЦР к настоящему времени позволило создать наборы праймеров для идентификации всех представителей риккетсиозов, бартонеллеза, эрлихиозов и коксиеллеза. В отношении возбудителей рода Rickettsia применяют праймеры, синтезированные на основе фрагментов гена цитрат синтазы риккетсий Провачека, генов 17 кДА, 120 и 190 белков риккетсий Риккетса. Введение в ПЦР праймеров гена 16Sr RNA впервые представило возможность индикации широкого круга возбудителей и их выявления в сложных, неясных случаях заболеваний. При поисках возбудителя болезни кошачьих царапин, Bartonella henselae, а также других бартонеллезов и эрлихиозов в ПЦР были введены праймеры гена цитрат синтазы. Праймеры генов 16SrRNA, а также 56кДА белкового антигена, используют для идентификации возбудителя лихорадки цуцугамуши. Род коксиелла тестируют праймерами на основе гена 23г ДНК. Поскольку специфические видовые праймеры для родов Rickettsia, Orienta, Bartonella и Coxiella в настоящее время отсутствуют, полученные в ПЦР фрагменты нуклеиновых кислот подвергают дополнительному рестрикционному анализу для дифференциации видов.
Из вышеизложенного очевидно, что полная клиническая диагностика рассматриваемой группы инфекций с определением таксономической принадлежности отдельных ее возбудителей невозможна без привлечения современных серологических и молекулярно-генетических методов исследования. Это положение подтвердилось при расшифровке этиологии так называемой «Астраханской лихорадки», заболеваний, связанных с бартонеллезами и эрлихиозами, и особенно, при определении распространения и выяснении природы отдаленных осложнений коксиеллеза.