Иксодовые клещи — паразиты и переносчики инфекций
Продолжительность жизни и физиологический возраст
Голодные клещи, за немногими исключениями, как например личинки и нимфы некоторых видов Dermacentor, отличаются значительной индивидуальной долговечностью, варьирующей от нескольких месяцев до 2.5—3 лет (табл. 10). Способность к длительному выживанию без пищи является важнейшей адаптацией к временному паразитизму иксодид. При низких плотностях популяций шансы встречи паразита и хозяина невелики и увеличиваются за счет длительного переживания инвазионной стадии в окружающей среде.
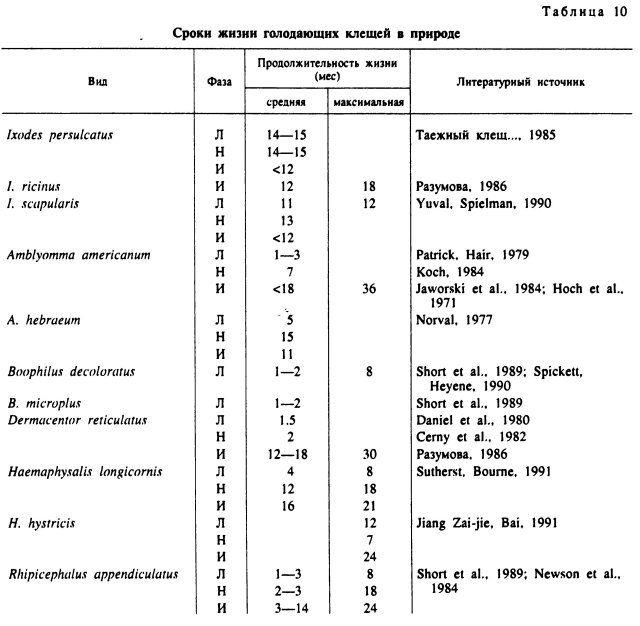
Сроки жизни голодных клещей в природе определяют возрастной состав их популяций. У части видов, особенно с одногодичными моновольтинными циклами развития, распространены простые популяции, включающие особей преимущественно одной возрастной когорты и близкого календарного возраста. Примером могут быть клещи I. lividus, R. turanicus, H. detritum.
Сложные популяции могут быть образованы особями разных возрастных когорт (чаще весенней и осенней), а также принадлежащими к двум и более последовательным поколениям. Они свойственны многим видам Ixodes, Haemaphysalis, Dermacentor, Amblyomma и наиболее детально исследованы у D. reticulatus, А. Americanum, I. persulcatus и I. ricinus.
Данные о продолжительности жизни голодающих клещей получены прямыми наблюдениями над лабораторными культурами или же в природе над особями, находящимися в садках, а также путем выпуска и повторного отлова меченых клещей. Для оценки возрастного состава природных популяций клещей был предложен метод определения их физиологического возраста, апробированный для имагинальной фазы. Физиологический возраст голодающих клещей отражает необратимые изменения в их организме, связанные с. расходованием энергетических резервов и накоплением конечных продуктов метаболизма в организме, и он может не совпадать с календарным возрастом. Комплексная оценка анатомических и гистологических изменений, наблюдающихся при старении голодных клещей, позволила разработать шкалу для выявления особей разных физиологических возрастов. Наиболее удобно пользоваться 4-балльной шкалой (табл. 11), позволяющей различать свежеперелинявших (I возраст), молодых (II возраст), зрелых (III возраст) и старых (IV возраст) особей (Балашов, 1961; Разумова, 1977, 1982, 1987). Реже применяется более дробная 8-балльная шкала (Репкина, 1971).
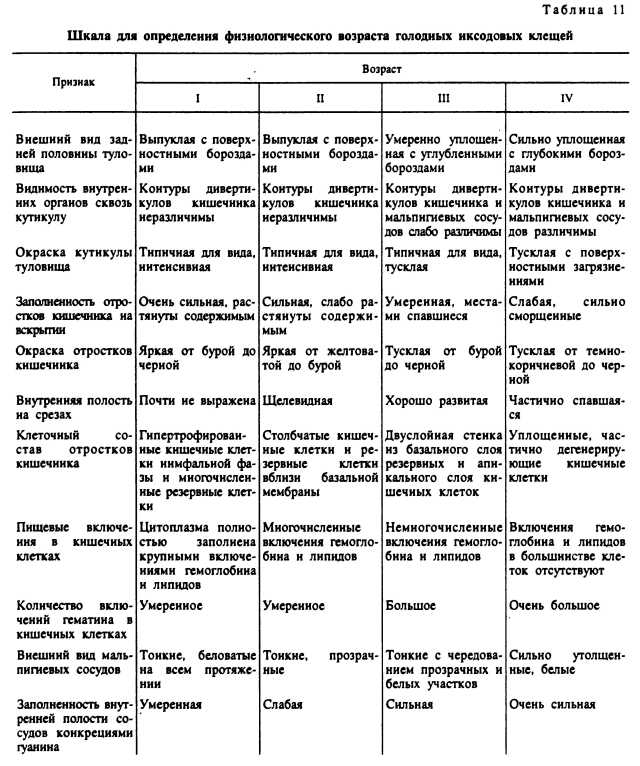
Внешне старение проявляется в постепенном уплощении тела и углублении борозд на его поверхности. В частности, у самок A. americanum за 12 мес жизни отношение длины переднего края скутума к длине цервикальной борозды уменьшилось с 4.057 до 2.357 (Jaworski et al., 1983). У имаго D. nuttalli у молодых особей задняя половина туловища растянута содержимым и ее дорсальная сторона выпуклая, а у старых истощенных особей она становится плоской (Pang et al., 1987). По мере старения у клещей происходит потускнение окраски тела, а у самок рода Ixodes у старых истощенных особей сквозь покровы просвечивают контуры отростков кишечника и мальпигиевых сосудов.
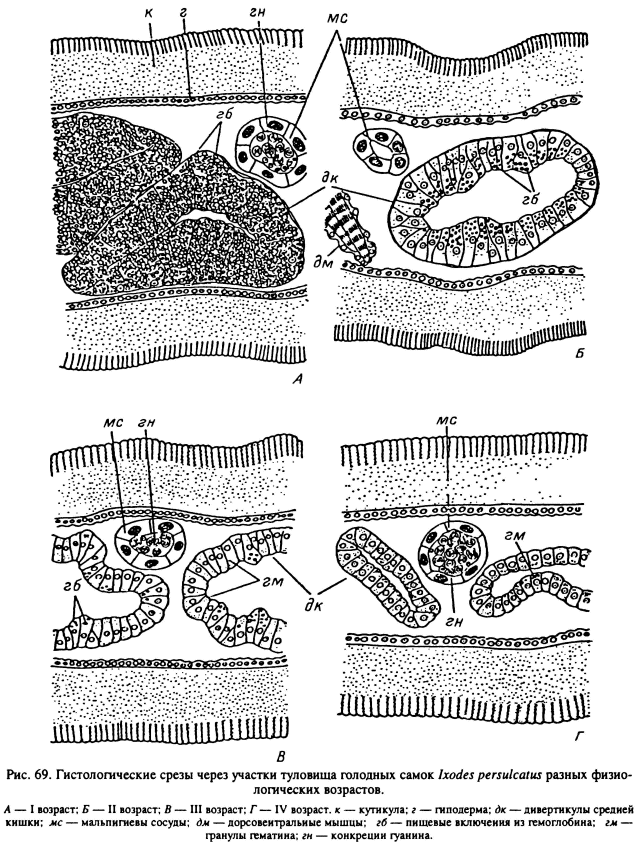
При вскрытиях клещей и на гистологических срезах процессы старения проявляются в уменьшении объема отростков кишечника и изменениях их окраски (табл. XXXVI). На гистологических срезах взрослых I. ricinus, I. persulcatus и D. reticulatus четко прослеживалось уменьшение количества внутриклеточных включений гемоглобина и увеличение количества более мелких конкреций гематина (табл. XX; рис. 69). Последние представляют конечный продукт внутриклеточного переваривания гемоглобина. Важным критерием старения служит заполнение мальпигиевых сосудов и ректального пузыря конкрециями гуанина. Определенные изменения отмечены в структуре жирового тела и нефроцитов.
У имаго R. appendiculatus хорошими критериями возраста оказались изменения в слюнных железах. По мере старения меняются диаметр альвеол III типа и заполненность секреторными включениями находящихся в них клеток е. По этим признакам среди собранных на пастбище клещей были выделены молодые, зрелые и старые особи (Walker, Fletcher, 1985).
Динамика накопления конкреций гуанина и уменьшение содержания белка в организме были количественно прослежены на протяжении 500 сут после нимфального питания R. appendiculatus и Н. anatolicum (Reid, Boid, 1984). Электронно-микроскопическое изучение средней кишки голодающих A. americanum выявило достоверные ультраструктурные изменения в цитоплазме клеток, связанные с постепенным уменьшением количества содержащих железо электронно-плотных лизосом и заменой их железосодержащими деградирующими лизосомами, а также с накоплением миелиновых включений. Описываемые процессы отражали усвоение гемоглобина внутри лизосом на протяжении 12 мес наблюдений. Процесс старения у этого вида клещей также был связан с уменьшением содержания липидов, тогда как содержание гликогена изменялось в меньшей степени (Jaworski et al., 1983, 1984). У личинок A. americanum, A. maculatum, A. nitens, В. microplus (Wright, 1989) на протяжении 6 недель после вылупления при значительной индивидуальной изменчивости прослежено повышение активности холинэстеразы и уменьшение общего белка организма.
Эти и другие физиологические и биохимические изменения, связанные со старением, влияют на чувствительность клещей к неблагоприятным факторам. В частности, у стареющих особей заметно увеличивается чувствительность к акарицидам, как например у личинок и нимф R. appendiculatus и A. hebraeum (Heller-Haupt, Varma, 1982), у всех фаз A. americanum (Mount, 1984) и у имаго I. persulcatus (Успенский, Репкина, 1974). Возраст клещей влияет также на их восприимчивость и способность к передаче возбудителей трансмиссивных инфекций. Например, при заражении вирусом клещевого энцефалита молодых самок (через 2—26 сут после линьки) I. ricinus и D. andersoni титр вируса в клещах возрастал через 10—12 сут в 3—4 раза, а в возрасте 65—74 сут — только в 1.5 раза (Мишаева и др., 1990). При парентеральном заражении вирусом клещевого энцефалита собранных в природе самок D. marginatus максимальное число случаев выделения вируса со слюной (50 %) было отмечено у зрелых особей III возраста, реже у старых особей IV возраста (17 %), но полностью отсутствовало у молодых клещей II возраста (Разумова, Алексеев, 1991).
Практическая применимость предложенной нами шкалы оценки физиологического возраста голодных клещей была подтверждена многолетним мониторингом природной популяции D. reticulatus в Московской области (рис. 70) (Разумова, 1986). Наиболее молодым был состав популяции весной, когда в апреле особи II и III возрастов составляли 85—94 %. Однако тогда же встречались и старые клещи IV возраста, пережившие не менее двух зимовок. Осенью, в октябре, преобладали клещи III—IV возрастов (88—93 %), имевшие календарный возраст не менее одного года, и молодые клещи II возраста. Возрастной состав популяций значительно варьировал в разные годы и в определенной степени отражал колебания погодных условий. Кроме того, обнаружены различия в скорости старения особей одного календарного возраста.
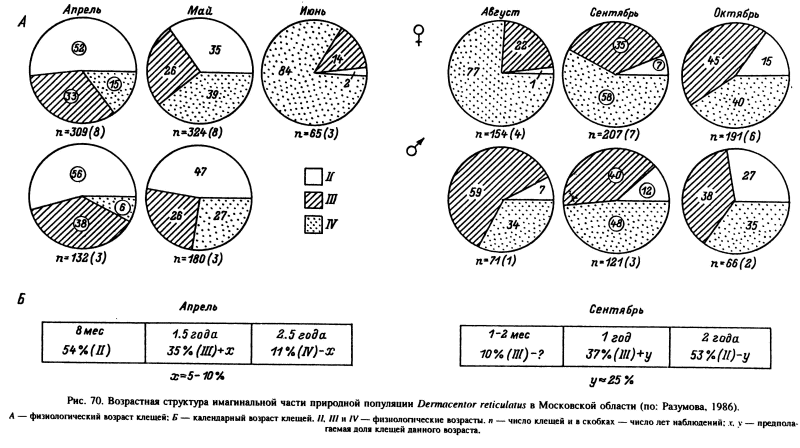
Результаты прямых наблюдений над судьбой этих клещей в садках или меченых особей в природе, когда исключалась возможность их исчерпания хозяевами, в общих чертах совпали с приведенными выше данными. Перелинявшие в конце лета и осенью клещи в подавляющей массе не активизировались, а уходили на злмовку, которую переживали с очень небольшими потерями. Если принять численность переживших первую зимовку клещей за 100 %, то до наступления летней неактивности доживало 98 %, а к концу осенней активности в среднем до 80 % особей (в разные годы от 51 до 97 %). Критическим периодом в жизни клещей была вторая зимовка, после которой весной сохранилось 32 % исходной популяции. До осени дожило около 4 % клещей, а третью зимовку пережило только 2 % (рис. 49). Несмотря на возраст, на протяжении около 2.5 лет эти клещи сохранили способность к нормальному прикреплению и питанию. Выживание более 2 лет отмечено для голодных взрослых D. reticulatus в открытых луговых ландшафтах и в лесу в Чехии и Польше. При этом максимальная продолжительность жизни для особей, отловленных и повторно выпущенных в их местообитания, составила 722 сут (Cerny et al., 1982).
Несомненно, что возрастная группа популяций D. reticulatus характеризуется максимальной разнородностью по физиологическому и календарному возрастам (рис. 70). Одновременно ее образуют особи трех физиологических возрастов. Весной доминируют особи II и III возрастов и двух последовательных поколений через 7—8 и 18 мес после линьки. Осенью преобладают особи III и IV возрастов, представляющие когорты 1-го и 2-го годов после линьки. На протяжении сезона активности в весенне-летние месяцы популяция постепенно стареет, а с осени происходит ее частичное омоложение. С учетом единичных клещей, переживших три зимовки, в составе популяции этого вида могут одновременно присутствовать и поддерживать панмиксию взрослые особи, принадлежащие к трем последовательным поколениям.
Сходная разновозрастная структура природных популяций, включающая особей 2 и в меньшей степени 3 последовательных генераций, была выявлена при изучении физиологического возраста у клещей D. nuttalli (Pang et al., 1987), D. silvarum (Репкина, 1980) и D. marginatus (Рухкян, 1985).
У клещей I. persulcatus с единственным весенне-летним периодом активности весной на растительность поднимаются взрослые особи, ушедшие на зимовку после осенней линьки. За время их активности происходит постепенное старение популяции. В начале сезона преобладают особи II и III возрастов, а в конце — III и IV возрастов. В связи с длительным периодом активации, занимающим 1—2 мес, особи, поднимающиеся на растительность в начале сезона, обладают большими пищевыми резервами, чем клещи, впервые активизировавшиеся к началу лета. По-видимому, этим можно объяснить и разную продолжительность жизни голодных клещей (Балашов, 1962). Продолжительность жизни взрослых клещей в природе в зависимости от гигротермических условий может варьировать от 1 до 61 сут. Особи поздних сроков активации жили в 3—15 раз меньше, чем особи ранних сроков. В целом прослеживается корреляция между показателями физиологического старения клещей и их отмирания в природе. Возможность повторной зимовки клещей исключается, так как в природе все они погибают в течение летнего сезона в связи с исчерпанием пищевых ресурсов. Несмотря на близкий календарный возраст от времени окончания осенней линьки до гибели в течение единственного сезона активности, природные популяции этого вида также образованы из особей нескольких генераций. К синхронной осенней линьке напитавшихся нимф в имаго приступают особи 3 разных когорт. В зависимости от сроков предшествующего развития они могут иметь возраст в 2, 3 и 4 года (Балашов, 1962; Хижинский, 1963, 1968; Лыков, 19666, 1966в; Репкина, Успенский, 1980; Таежный клещ..., 1985).
У I. ricinus в отличие от I. persulcatus возможен и повторный осенний пик активности. Он может быть обусловлен как повторной активизацией клещей прошлого года, переживших лето, так и активизацией части свежеперелинявших особей. В разных частях ареала соотношение между старыми и молодыми клещами в период осенней активности различно.
Так, в Ленинградской области (Балашов, 1962) весной преобладали самки II (60*%) и III (34 %) возрастов, а в июле доминировали самки III возраста (62 %). В сентябре же после летнего спада активности в популяции вновь были многочисленны самки II возраста (45 %), но одновременно встречались и старые особи IV возраста (22 %). В Московской области (Разумова, 1986), отличающейся более континентальным климатом, весенний возрастной состав популяции был сходен с таковым в Лениниградской области. В ней также преобладали самки II (60 %) и 111 (25 %) возрастов, но были и особи IV возраста (15 %). В сентябре же, в отличие от Ленинграда, доля молодых, недавно перелинявших клещей II возраста была невелика (10 %) и преобладали более старые клещи III (39 %) и IV (51 %) возрастов. По-видимому, сложный состав природных популяций I. ricinus определяется не только разными сроками развития особей одной генерации, но и возможностью переживания частью активизировавшихся весной клещей второй зимы и их повторной активации следующей весной вместе с основной массой молодых клещей, переживших только одну зимовку.
Таким образом, в условиях умеренного климата наибольшая продолжительность индивидуальной жизни свойственна взрослым особям рода Dermacentor, обладающим поведенческой диапаузой и живущим до 2 лет и более. Напротив, у I. persulcatus и I. ricinus сроки жизни взрослых после их весенней активации не превышают в природе 2—3 мес и также зависят от температуры и влажности в их местообитаниях.
Сроки жизни голодных клещей наряду с видовыми особенностями в значительной степени зависят от условий окружающей среды и особенно от температуры и влажности в их местообитаниях. Например, в условиях травянистой саванны в Зимбабве в зависимости от сезона года и высоты травостоя сроки выживания голодных личинок, нимф и взрослых R. cppendiculatus, а также личинок В. microplus и В. decoloratus различались более чем в 2 раза (табл. 10) (Short et al., 1989). Подобные же различия в продопжительности жизни обнаружены для взрослых, личинок и нимф R. appendiculatus и A. hebraewn на пастбищах в Замбии (Pegram, Banda, 1990). В Австралии продолжительность выживания голодных Н. longicornis на пастбищах также зависела от сезона года, высоты травяного покрова и ирригации. Наибольшие сроки жизни нимф (300 сут) были в местообитаниях с высокой травой и у особей, перелинявших в конце лета, а наименьшие (100 сут) — при нахождении в низкой траве и после линьки в начале лета. Половина (50 %) взрослых особей, перелинявших в конце зимы, выживала в высокой траве 400 сут, а перелинявшие в начале зимы — 200 сут. В наиболее благоприятных условиях 50 % нимф жили 12 мес, а отдельные особи до 18 мес. Для взрослых аналогичные показатели составили 16 и 21 мес. Наибольшая длительность жизни во всех случаях была связана с пребыванием при низких зимних температурах (Sutherst, Bourne, 1991).
На пойкилотермных животных, которым принадлежат иксодовые клещи, температура окружающей среды влияет двояким образом. Она определяет верхнюю и нижнюю границы жизни вида, за пределами которых клещи гибнут от необратимых повреждений организма при его замерзании или перегреве. Не менее, а во многих случаях более существенна роль температурного фактора в регуляции скоростей разнообразных биологических процессов, определяющих сами возможности и скорости роста, развития и размножения этих членистоногих. В частности, недостаток тепла, а не опасность промерзания является лимитирующим фактором в продвижении на север многих видов иксодид в Евразии и Северной Америке.