Иксодовые клещи — паразиты и переносчики инфекций
Глава VII. ПРОТИВОКЛЕЩЕВАЯ РЕЗИСТЕНТНОСТЬ
Слюна клещей обладает сильной антигенной активностью, и некоторые из ее антигенов вызывают развитие противоклещевой резистентности к повторным питаниям паразитов. Резистентность может быть обусловлена несколькими типами иммунных механизмов, включая формирование защитных антител, блокирование реакций комплемента, выделение цитокининов и образование Т-лимфоцитов. Исследованиям противоклещевого иммунитета за последние 20 лет посвящено большое количество публикаций, в том числе несколько обзорных статей (Allen, 1992; Wikel, 1996). Рассмотрение столь обширной проблемы не входит в задачи настоящей книги, и мы решили ограничиться анализом экологических последствий приобретенной противоклещевой резистентности и ее места в паразитарной системе паразит—позвоночное животное.
Впервые противоклещевая резистентность была описана Трегером (Trager, 1939). В его опытах кролики и морские свинки после кормления на них личинок и нимф D. variabilis приобретали высокую степень устойчивости к повторным нападениям этих клещей. Последующие исследования других авторов с кормлением личинок D. andersoni на морских свинках дали сходные результаты. При первом заражении питание заканчивали 70—99 % личинок, при повторном — только 5—25 %. Немногие, питавшиеся на устойчивых свинках личинки часто откреплялись в процессе питания, а масса тела напитавшихся особей была значительно ниже, чем в контроле. Многочисленными экспериментами была установлена выработка противоклещевой устойчивости у многих видов лабораторных и сельскохозяйственных животных (Wikel, 1996).
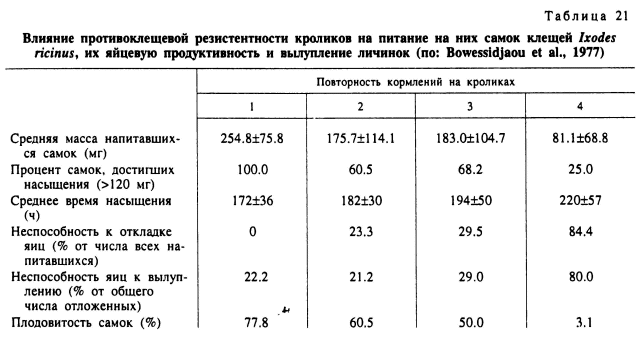
Приобретенная устойчивость проявляется в уменьшенном количестве напитавшихся клещей вследствие гибели части их в процессе прикрепления и на более поздних сроках питания, в удлинении времени питания, уменьшении массы крови, поглощенной напитавшимися особями, снижении процента перелинявших нимф и имаго, уменьшении числа отложенных яиц и вылупившихся из них личинок (табл. 21). Противоклещевая устойчивость возникает как ответ на поступление в организм хозяина клещевых антигенов, и для его развития требуется не менее 1—2 нед. Защитный характер иммунных реакций проявляется главным образом в различных нарушениях питания паразита или же в его интоксикации определенными компонентами пищи (Agbede, Kemp, 1986; Wikel, 1996). Интенсивность разнообразных оборонительных реакций самоочищения хозяина (счесывание, раздавливание, выгрызание) также связана с его иммунным состоянием (рис. 82). У резистентных особей их уровень значительно выше, чем у несенсибилизированных (Brown, 1985).
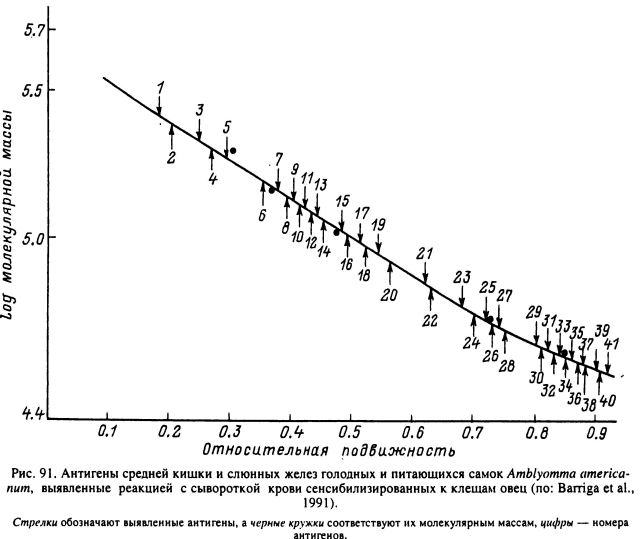
Общей реакцией позвоночных животных, включая млекопитающих, птиц, рептилий, на паразитирование клещей является образование антител. В процессе питания вместе со слюной в организм хозяина вводятся разнообразные антигены, которые в свою очередь стимулируют формирование гуморальных антител. Участие отдельных антигенов в развитии противоклещевой устойчивости изучено недостаточно, но несомненно, что лишь некоторые из них стимулируют формирование защитных антител. Так, при питании на овцах взрослых A. americanum со слюной выделяется 44 антигена с молекулярной массой от 19 000 до 190 000 (рис. 91). Наиболее богата антигенами слюна в начале питания, а на более поздних сроках выделение некоторых антигенов прекращается (Barriga et al., 1991). Антигены A. hebraewn с молекулярными массами 39 000 и 41 000 оказались сходными с таковыми (39 000, 40 000 и 41 000) у A. americanum (Brown, 1985). Общими иммуногенами для этих клещей, а также для- R. appendiculatus оказались антигены с молекулярными массами 65 000 и 66 000. Важными антигенами являются полипептиды слюны, формирующие вещество цементного футляра с молекулярной массой около 90 000. Они были выделены из слюнных желез и цементного футляра питающихся самок R. appendiculatus, R. sanguineus, D. variabilis, A. americanum (Jaworski et al., 1992). С помощью близкого к ним антигена с молекулярной массой 94 000 удалось иммунизировать кролика против R. appendiculatus (Shapiro et al., 1986; Nyiondo et al., 1989). Исключительно важное значение в создании иммунитета могут иметь антигены клеток средней кишки (Agbede, Kemp, 1986; Willadsen, Kemp, 1988), которые могут попадать в организм хозяина естественным путем в процессе периодического отрыгивания содержимого кишечника (Brown, 1988).
Сенсибилизация организма хозяина осуществляется при первом его контакте с клещевыми антигенами. Полагают, что антигены связываются клетками Лангерганса кожи, активизируют Т- и В-лимфоциты и в конечной цепи процесса образуют антитела, большая часть которых относится к классам IgG и IgE (Worms et al., 1988). Часть антител циркулирует в крови, и они легко выявляются различными иммунобиологическими методами, а часть остается связанной со специализированными клетками кожи. Немногие из клещевых агентов являются «функционирующими», т. е. стимулируют развитие защитного противоклещевого иммунитета. Часть же их прямо не связана с резистентностью хозяина, хотя они могут быть важны в иммунодиагностике или же участвуют в иммунологических реакциях.
Защитное действие гуморальных антител доказано у морских свинок против D. variabilis (Allen, 1992), кроликов против I. ricinus (Лабецкая, 1990; Brossard, 1992) и крупного рогатого скота против В. microplus (Roberts, Кегг, 1976). Связь антител с лимфоцитами подтвердили опыты с трансфузией иммунных лимфоцитов морских свинок, которые обеспечивали большую устойчивость против D. andersoni и I. ricinus, чем при переливании одной сыворотки крови (Лабецкая, 1990; Wikel, 1996).
У устойчивых к клещам животных обнаружена прямая связь между титрами антител в крови и уровнем резистентности, как в случае с кроликами и Н. longicorws (Fujisaki et al., 1980) или крупным рогатым скотом и В. microplus (Brossard, 1976). Напряженность противоклещевого иммунитета положительно коррелирует и с интенсивностью кожной реакции на клещевые антигены. Этим методом было установлено, что при выпасе крупного рогатого скота на естественном пастбище в Замбии с высокой численностью клещей A. variegatum и R. appendiculatus у животных с минимальным числом питающихся на них имаго (соответственно 18 и 60 особей) кожная реакция была выражена в максимальной степени, а у наиболее заклещевленных особей (1067 и 260 клещей) она практически не обнаруживалась (Jongejan et al., 1989). Подобная же отрицательная корреляция установлена между числом паразитирующих на флоридском кролике (Sylvilagus floridanus) клещей Н. leporispalustris и интенсивностью кожной реакции (McGowan et al., 1982).
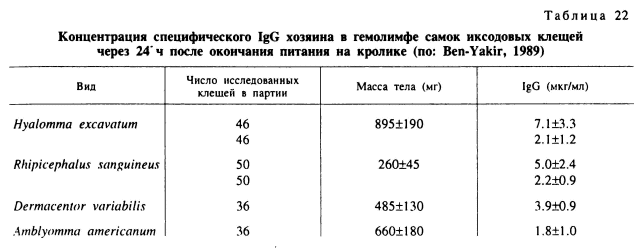
Циркулирующие в крови хозяина антитела были обнаружены в гемолимфе питающихся самок D. variabilis (Ackerman et al., 1981), В. microplus (Tracey-Patte et al., 1987), H. excavatum и R. sanguineus (Ben-Yakir, 1989), куда они проникают из полости кишечника сквозь его стенку (табл. 22). Механизм действия антител хозяина на клеща окончательно не установлен. Антитела комплемента направлены против антигенов средней кишки В. microplus. Проникая в кишечник вместе с пищей, они непосредственно повреждают клетки стенок средней кишки (Agbede, Kemp, 1986; Kemp et al., 1989). Патологические изменения и разрушения клеток средней кишки были обнаружены и у самок A. americanum, питавшихся на резистентных морских свинках (Voss-McCowan, Wikel, 1992). Антитела против антигенов слюнных желез, по-видимому, могут действовать и опосредованно. Они могут стимулировать цепи реакций, конечные звенья которых нарушают нормальное питание или токсичны для паразитов.
У резистентных животных уже с первых минут прикрепления клещей возникает местная реакций кожной гиперчувствительности немедленного типа с инфильтрацией базофилов. В результате ротовые органы прикрепившегося клеща могут быть изолированы от притока крови сгустком базофилов и сетью коллагеновых волокон и питание становится невозможным (Мусатов, 1978; Walker, Fletcher, 1986; Allen, 1989, 1992). Решающую роль в развитии этой реакции играет гистамин и, возможно, другие вазоактивные амины. Повышенный уровень гистамина был обнаружен в коже крупного рогатого скота в местах прикрепления личинок В. microplus (Willadsen et al., 1979) и D. andersoni у морских свинок (Wikel, 1996). Прямыми экспериментами было установлено, что введение гистамина подкожно в места питания личинок В. microplus или же в переживающие препараты кожи с этими клещами стимулировало отторжение личинок. Чувствительность снижалась с удлинением сроков их питания, и они полностью переставали реагировать на гистамин через 3 сут после начала прикрепления (Kemp, Bourne, 1980). Введение сенсибилизированным к клещам животным антигистаминных препаратов блокировало реакцию гиперчувствительности на клещевые антигены и одновременно снижало уровень устойчивости животных к заклещевлению (Willadsen et al., 1979; Brossard, 1992).
Механизмы прямого воздействия гистамина на питание клещей еще не раскрыты. Несомненна лишь его роль в стимулировании реакций механического самоочищения хозяина в ответ на вызываемые гистамином местные болевые ощущения (Koudstaal et al., 1978). Предполагают (Wikel, 1996), что гистамин выделяется у сенсибилизированных животных при взаимодействии клещевого антигена с антителами на поверхности тучных клеток в коже. Местная дегрануляция тучных клеток с освобождением гистамина непосредственно вокруг и под окончанием хоботка питающихся личинок В. microplus была показана на электронно-микроскопических препаратах (Schleger et al., 1976). У линии мышей, дефицитных по тучным клеткам, противоклещевой иммунитет был значительно слабее, чем у нормальных животных (Matsuda, Kiso, 1988).
Вторым важным источником гистамина служат базофилы, накопление которых в местах прикрепления клещей в первые часы и дни питания описано у морских свинок и белых мышей (Allen, 1989), кроликов (Brossard, Fivaz, 1982), крупного рогатого скота (Wikel, 1996). Введение хозяевам антибазофильной сыворотки значительно снижало уровень противоклещевой резистентности, тогда как введение противоэозинофильной сыворотки оказывало значительно меньший эффект (Brown, 1985). Накопление базофилов в месте питания клеща стимулируется растворимыми медиаторами, которые освобождаются отреагировавшими на клещевые антигены Т-лимфоцитами (Kaufman, 1989; Wikel, 1996).
Неясна в противоклещевом иммунитете роль эозинофилов, хотя обнаружена интенсивная местная инфильтрация последних в коже крупного рогатого скота, вокруг места прикрепления В. microplus, особенно с середины питания, и их последующая деградация (Schleger et al., 1981). В то же время питание R. sanguineus на собаках (Theis, Budwiser, 1974) и D. andersoni на морских свинках (Wikel, 1996) не сопровождалось развитием эозинофилии.
Наряду с реакциями немедленной гиперчувствительности противоклещевая резистентность проявляется в форме кожных реакций замедленного типа, напоминающих феномен Артюса. В результате в местах прикрепления паразитов не развиваются необходимые для нормального насыщения геморрагии. Вместо них наблюдаются гнойно-некротические процессы с образованием в дерме обширных полостей с жидким содержимым. Нормальное питание клещей становится невозможным, и они отторгаются вместе с поврежденными участками кожи. В развитии описанных реакций замедленного типа несомненно принимает участие активированная антигенами система комплемента, стимулирующая освобождение цитолизинов и анафилотоксинов.
Механизмы противоклещевой резистентности
Слюна клещей обладает сильной антигенной активностью, и некоторые из ее антигенов вызывают развитие противоклещевой резистентности к повторным питаниям паразитов. Резистентность может быть обусловлена несколькими типами иммунных механизмов, включая формирование защитных антител, блокирование реакций комплемента, выделение цитокининов и образование Т-лимфоцитов. Исследованиям противоклещевого иммунитета за последние 20 лет посвящено большое количество публикаций, в том числе несколько обзорных статей (Allen, 1992; Wikel, 1996). Рассмотрение столь обширной проблемы не входит в задачи настоящей книги, и мы решили ограничиться анализом экологических последствий приобретенной противоклещевой резистентности и ее места в паразитарной системе паразит—позвоночное животное.
Впервые противоклещевая резистентность была описана Трегером (Trager, 1939). В его опытах кролики и морские свинки после кормления на них личинок и нимф D. variabilis приобретали высокую степень устойчивости к повторным нападениям этих клещей. Последующие исследования других авторов с кормлением личинок D. andersoni на морских свинках дали сходные результаты. При первом заражении питание заканчивали 70—99 % личинок, при повторном — только 5—25 %. Немногие, питавшиеся на устойчивых свинках личинки часто откреплялись в процессе питания, а масса тела напитавшихся особей была значительно ниже, чем в контроле. Многочисленными экспериментами была установлена выработка противоклещевой устойчивости у многих видов лабораторных и сельскохозяйственных животных (Wikel, 1996).
Приобретенная устойчивость проявляется в уменьшенном количестве напитавшихся клещей вследствие гибели части их в процессе прикрепления и на более поздних сроках питания, в удлинении времени питания, уменьшении массы крови, поглощенной напитавшимися особями, снижении процента перелинявших нимф и имаго, уменьшении числа отложенных яиц и вылупившихся из них личинок (табл. 21). Противоклещевая устойчивость возникает как ответ на поступление в организм хозяина клещевых антигенов, и для его развития требуется не менее 1—2 нед. Защитный характер иммунных реакций проявляется главным образом в различных нарушениях питания паразита или же в его интоксикации определенными компонентами пищи (Agbede, Kemp, 1986; Wikel, 1996). Интенсивность разнообразных оборонительных реакций самоочищения хозяина (счесывание, раздавливание, выгрызание) также связана с его иммунным состоянием (рис. 82). У резистентных особей их уровень значительно выше, чем у несенсибилизированных (Brown, 1985).

Общей реакцией позвоночных животных, включая млекопитающих, птиц, рептилий, на паразитирование клещей является образование антител. В процессе питания вместе со слюной в организм хозяина вводятся разнообразные антигены, которые в свою очередь стимулируют формирование гуморальных антител. Участие отдельных антигенов в развитии противоклещевой устойчивости изучено недостаточно, но несомненно, что лишь некоторые из них стимулируют формирование защитных антител. Так, при питании на овцах взрослых A. americanum со слюной выделяется 44 антигена с молекулярной массой от 19 000 до 190 000 (рис. 91). Наиболее богата антигенами слюна в начале питания, а на более поздних сроках выделение некоторых антигенов прекращается (Barriga et al., 1991). Антигены A. hebraewn с молекулярными массами 39 000 и 41 000 оказались сходными с таковыми (39 000, 40 000 и 41 000) у A. americanum (Brown, 1985). Общими иммуногенами для этих клещей, а также для- R. appendiculatus оказались антигены с молекулярными массами 65 000 и 66 000. Важными антигенами являются полипептиды слюны, формирующие вещество цементного футляра с молекулярной массой около 90 000. Они были выделены из слюнных желез и цементного футляра питающихся самок R. appendiculatus, R. sanguineus, D. variabilis, A. americanum (Jaworski et al., 1992). С помощью близкого к ним антигена с молекулярной массой 94 000 удалось иммунизировать кролика против R. appendiculatus (Shapiro et al., 1986; Nyiondo et al., 1989). Исключительно важное значение в создании иммунитета могут иметь антигены клеток средней кишки (Agbede, Kemp, 1986; Willadsen, Kemp, 1988), которые могут попадать в организм хозяина естественным путем в процессе периодического отрыгивания содержимого кишечника (Brown, 1988).

Сенсибилизация организма хозяина осуществляется при первом его контакте с клещевыми антигенами. Полагают, что антигены связываются клетками Лангерганса кожи, активизируют Т- и В-лимфоциты и в конечной цепи процесса образуют антитела, большая часть которых относится к классам IgG и IgE (Worms et al., 1988). Часть антител циркулирует в крови, и они легко выявляются различными иммунобиологическими методами, а часть остается связанной со специализированными клетками кожи. Немногие из клещевых агентов являются «функционирующими», т. е. стимулируют развитие защитного противоклещевого иммунитета. Часть же их прямо не связана с резистентностью хозяина, хотя они могут быть важны в иммунодиагностике или же участвуют в иммунологических реакциях.
Защитное действие гуморальных антител доказано у морских свинок против D. variabilis (Allen, 1992), кроликов против I. ricinus (Лабецкая, 1990; Brossard, 1992) и крупного рогатого скота против В. microplus (Roberts, Кегг, 1976). Связь антител с лимфоцитами подтвердили опыты с трансфузией иммунных лимфоцитов морских свинок, которые обеспечивали большую устойчивость против D. andersoni и I. ricinus, чем при переливании одной сыворотки крови (Лабецкая, 1990; Wikel, 1996).
У устойчивых к клещам животных обнаружена прямая связь между титрами антител в крови и уровнем резистентности, как в случае с кроликами и Н. longicorws (Fujisaki et al., 1980) или крупным рогатым скотом и В. microplus (Brossard, 1976). Напряженность противоклещевого иммунитета положительно коррелирует и с интенсивностью кожной реакции на клещевые антигены. Этим методом было установлено, что при выпасе крупного рогатого скота на естественном пастбище в Замбии с высокой численностью клещей A. variegatum и R. appendiculatus у животных с минимальным числом питающихся на них имаго (соответственно 18 и 60 особей) кожная реакция была выражена в максимальной степени, а у наиболее заклещевленных особей (1067 и 260 клещей) она практически не обнаруживалась (Jongejan et al., 1989). Подобная же отрицательная корреляция установлена между числом паразитирующих на флоридском кролике (Sylvilagus floridanus) клещей Н. leporispalustris и интенсивностью кожной реакции (McGowan et al., 1982).
Циркулирующие в крови хозяина антитела были обнаружены в гемолимфе питающихся самок D. variabilis (Ackerman et al., 1981), В. microplus (Tracey-Patte et al., 1987), H. excavatum и R. sanguineus (Ben-Yakir, 1989), куда они проникают из полости кишечника сквозь его стенку (табл. 22). Механизм действия антител хозяина на клеща окончательно не установлен. Антитела комплемента направлены против антигенов средней кишки В. microplus. Проникая в кишечник вместе с пищей, они непосредственно повреждают клетки стенок средней кишки (Agbede, Kemp, 1986; Kemp et al., 1989). Патологические изменения и разрушения клеток средней кишки были обнаружены и у самок A. americanum, питавшихся на резистентных морских свинках (Voss-McCowan, Wikel, 1992). Антитела против антигенов слюнных желез, по-видимому, могут действовать и опосредованно. Они могут стимулировать цепи реакций, конечные звенья которых нарушают нормальное питание или токсичны для паразитов.

У резистентных животных уже с первых минут прикрепления клещей возникает местная реакций кожной гиперчувствительности немедленного типа с инфильтрацией базофилов. В результате ротовые органы прикрепившегося клеща могут быть изолированы от притока крови сгустком базофилов и сетью коллагеновых волокон и питание становится невозможным (Мусатов, 1978; Walker, Fletcher, 1986; Allen, 1989, 1992). Решающую роль в развитии этой реакции играет гистамин и, возможно, другие вазоактивные амины. Повышенный уровень гистамина был обнаружен в коже крупного рогатого скота в местах прикрепления личинок В. microplus (Willadsen et al., 1979) и D. andersoni у морских свинок (Wikel, 1996). Прямыми экспериментами было установлено, что введение гистамина подкожно в места питания личинок В. microplus или же в переживающие препараты кожи с этими клещами стимулировало отторжение личинок. Чувствительность снижалась с удлинением сроков их питания, и они полностью переставали реагировать на гистамин через 3 сут после начала прикрепления (Kemp, Bourne, 1980). Введение сенсибилизированным к клещам животным антигистаминных препаратов блокировало реакцию гиперчувствительности на клещевые антигены и одновременно снижало уровень устойчивости животных к заклещевлению (Willadsen et al., 1979; Brossard, 1992).
Механизмы прямого воздействия гистамина на питание клещей еще не раскрыты. Несомненна лишь его роль в стимулировании реакций механического самоочищения хозяина в ответ на вызываемые гистамином местные болевые ощущения (Koudstaal et al., 1978). Предполагают (Wikel, 1996), что гистамин выделяется у сенсибилизированных животных при взаимодействии клещевого антигена с антителами на поверхности тучных клеток в коже. Местная дегрануляция тучных клеток с освобождением гистамина непосредственно вокруг и под окончанием хоботка питающихся личинок В. microplus была показана на электронно-микроскопических препаратах (Schleger et al., 1976). У линии мышей, дефицитных по тучным клеткам, противоклещевой иммунитет был значительно слабее, чем у нормальных животных (Matsuda, Kiso, 1988).
Вторым важным источником гистамина служат базофилы, накопление которых в местах прикрепления клещей в первые часы и дни питания описано у морских свинок и белых мышей (Allen, 1989), кроликов (Brossard, Fivaz, 1982), крупного рогатого скота (Wikel, 1996). Введение хозяевам антибазофильной сыворотки значительно снижало уровень противоклещевой резистентности, тогда как введение противоэозинофильной сыворотки оказывало значительно меньший эффект (Brown, 1985). Накопление базофилов в месте питания клеща стимулируется растворимыми медиаторами, которые освобождаются отреагировавшими на клещевые антигены Т-лимфоцитами (Kaufman, 1989; Wikel, 1996).
Неясна в противоклещевом иммунитете роль эозинофилов, хотя обнаружена интенсивная местная инфильтрация последних в коже крупного рогатого скота, вокруг места прикрепления В. microplus, особенно с середины питания, и их последующая деградация (Schleger et al., 1981). В то же время питание R. sanguineus на собаках (Theis, Budwiser, 1974) и D. andersoni на морских свинках (Wikel, 1996) не сопровождалось развитием эозинофилии.
Наряду с реакциями немедленной гиперчувствительности противоклещевая резистентность проявляется в форме кожных реакций замедленного типа, напоминающих феномен Артюса. В результате в местах прикрепления паразитов не развиваются необходимые для нормального насыщения геморрагии. Вместо них наблюдаются гнойно-некротические процессы с образованием в дерме обширных полостей с жидким содержимым. Нормальное питание клещей становится невозможным, и они отторгаются вместе с поврежденными участками кожи. В развитии описанных реакций замедленного типа несомненно принимает участие активированная антигенами система комплемента, стимулирующая освобождение цитолизинов и анафилотоксинов.