Иксодовые клещи — паразиты и переносчики инфекций
Природная очаговость клещевых инфекций
Среди обширной группы инфекций, общих для человека и животных, которые называют зоонозами, в качестве особой группы выделяют природно-очаговые заболевания. В норме их возбудители циркулируют в дикой природе без участия человека. Человек является случайным звеном в их эпизоотической цепи и может заразиться при посещении природных очагов (Павловский, 1964). Иксодовые клещи являются переносчиками и резервуарами возбудителей многих природно-очаговых заболеваний, часто выделяемых в особый тип так называемых клещевых инфекций. Инфицированность природных популяций клещей определенным видом возбудителя является суммарным итогом многосторонних взаимодействий всех компонентов паразитарной системы, формирующих природный очаг инфекции. К сожалению, наши знания о циркуляции возбудителя между клещами и позвоночными ограничены немногими инфекциями и не охватывают всех возможных путей распространения возбудителя.
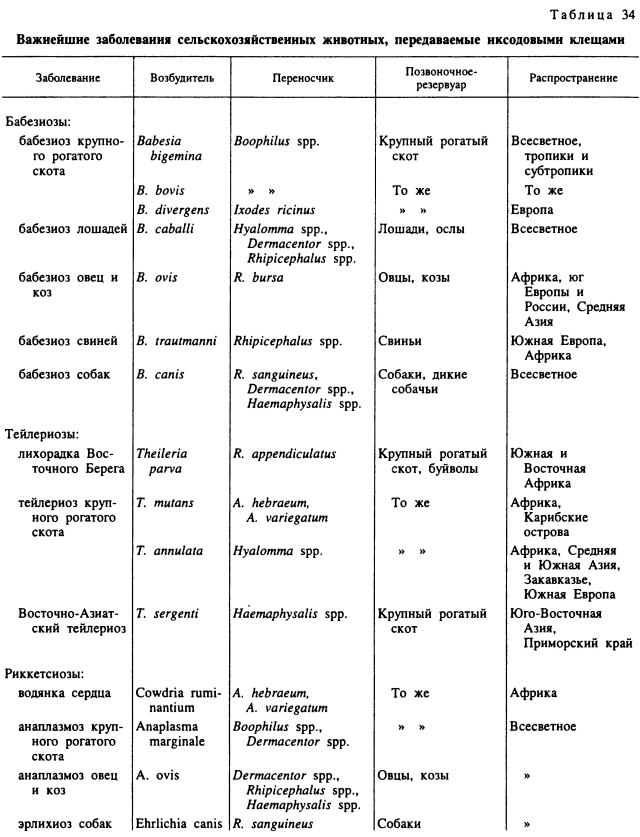
Литература об эпидемиологическом и эпизоотологическом значении отдельных видов клещей, собранная в библиографии по этой группе Хогстралом (Hoogstraal), насчитывала многие тысячи названий уже к 1988 г. За последующие годы этот список существенно увеличился, причем было установлено исключительно широкое распространение некоторых, до этого мало известных клещевых инфекций, как например болезни Лайм. Из клещевых инфекций на территории России и сопредельных государств наибольшее медико-ветеринарное значение имеют клещевой энцефалит, болезнь Лайм, геморрагическая лихорадка Крым-Конго, клещевой тиф Северной Азии, Омская геморрагическая лихорадка, лихорадка Ку, туляремия, а также анаплазмозы и пироплазмозы сельскохозяйственных животных. Важнейшие сведения об участии иксодовых клещей в передаче инфекций человека и сельскохозяйственных животных представлены в табл. 33 и 34.
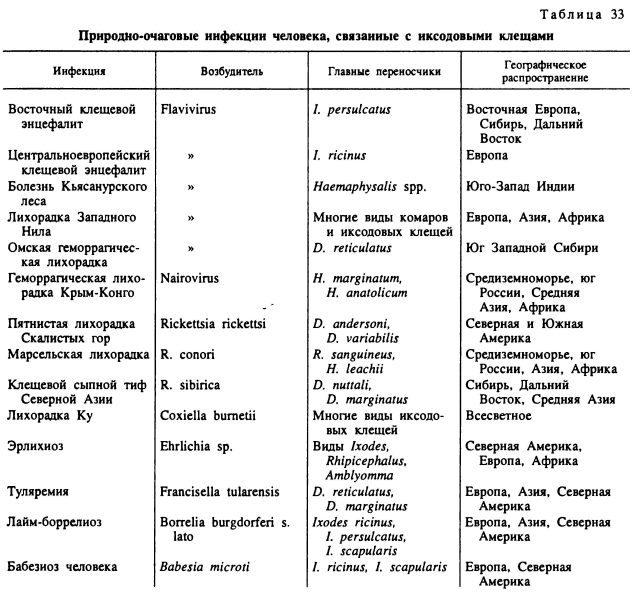
Лайм-боррелиоз исключительно широко распространен по всей лесной зоне России. Он также встречается в странах Западной, Центральной и Северной Европы, в Китае, Корее, Японии и Северной Америке. Возбудителем этой инфекции служат боррелии, объединяемые в группе Borrelia burgdorferi s. lato. Возбудитель отличается высокой генетической вариабельностью, и в настоящее время различают несколько геновидов (В. garinii, В. afzelii, В. burgdorferi s. str. и В. japonica) переносчиками которых известны только клещи рода Ixodes. В Евразии встречаются все 4 геновида, из которых в России наиболее распространены В. garinii и В. afzelii. Главными переносчиками боррелий служат клещи I. ricinus и I. persulcatus (Филиппова, 1990), а в Америке — I. scapularis. Дополнительными переносчиками в Европе могут быть также I. hexagonus (Gem et al., 1996), I. trianguliceps и среди морских птиц I. uriae (Olsen et al., 1995a). В Японии наряду с I. persulcatus переносчиком боррелий служит также I. ovatus со свойственным ему штаммом или даже видом боррелий В. japonica (Miyamoto et al., 1992).
Среди позвоночных животных природными резервуарами боррелий являются многие виды млекопитающих и птиц, видовой состав которых различен в разных частях нозоареала. В европейской части России главными резервуарами боррелий служат рыжие полевки Cletrionomys glareolus, а восточнее Урала этот вид как резервуар постепенно замещается С. rufocanus и С. rutilus. Местами важную роль могут также играть мыши рода Apodemus (Gorelova et al., 1995). В некоторых районах Швеции главными прокормителями клещей и резервуарами боррелий могут быть зайцы (Talleklint, Jaenson, 1996a, 1996b). В Англии эту функцию могут выполнять белки Sciurus carolinensis (Craine et al., 1995) и в некоторых странах Европы — ежи (Gray et al., 1994). Крупные млекопитающие и важнейшие прокормители клещей — олени, по-видимому, не могут служить природными резервуарами боррелий (Jaenson, Talleklint, 1992), хотя паразитирование на оленях уже инфицированных боррелиями клещей не вело к их освобождению от возбудителя (Rijpkema et al., 1996). Среди птиц доказана природная инфицированность боррелиями и способность к передаче возбудителя клещам у фазанов (Kurtenbach et al., 1996), нескольких видов воробьиных птиц, включая дроздов (Olsen et al., 1995b; Rand et al., 1996; Humair et al., 1996), а также у морских птиц, связанных с I. uriae (Olsen et al., 1995a).
Зараженность взрослых голодных клещей I. ricinus боррелиями обычно не превышает 20—40 %, а у I. persulcatus может достигать 90 % и более. Зараженность нимф обычно значительно ниже, а личинок не превышает 1—5 % (табл. 35). Заражение клещей происходит главным образом во время питания личинок и нимф на инфицированных позвоночных, во время совместного питания инфицированных и «чистых» клещей и половым путем. До последнего времени полагали, что трансовариальная передача имеет второстепенное значение в распространении возбудителя (Lane et al., 1991), но это положение требует переоценки. В Англии в одном из очагов Лайм-боррелиоза напитавшиеся самки I. ricinus передавали возбудителя трансовариально личинкам, а они при питании инфицировали большое количество восприимчивых хозяев (Randolph, Craine, 1995). Возбудитель зимует как в клещах, так и в мелких млекопитающих, для некоторых видов которых показано многомесячное носительство боррелий.
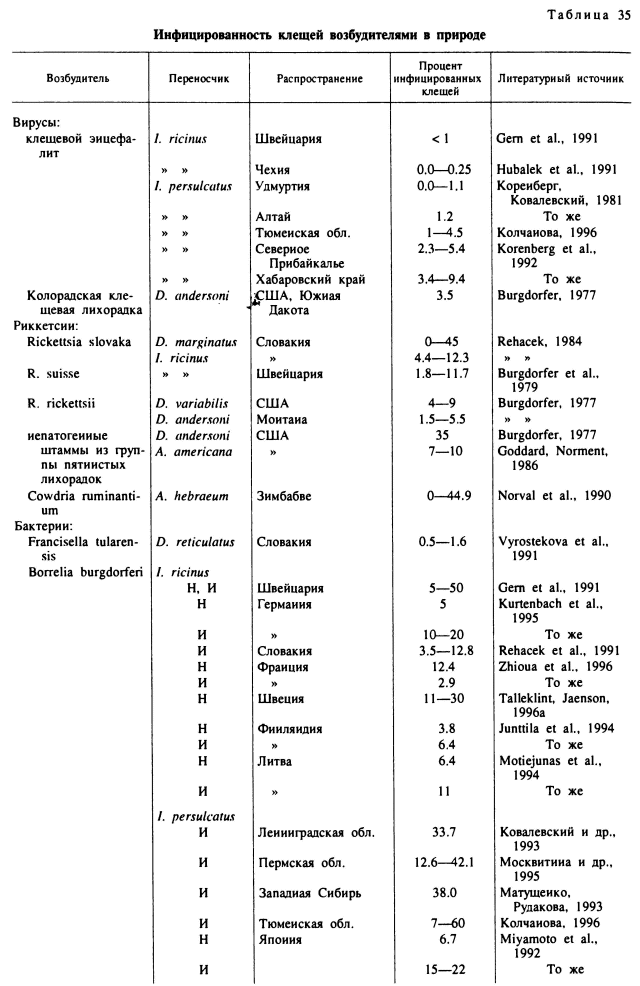
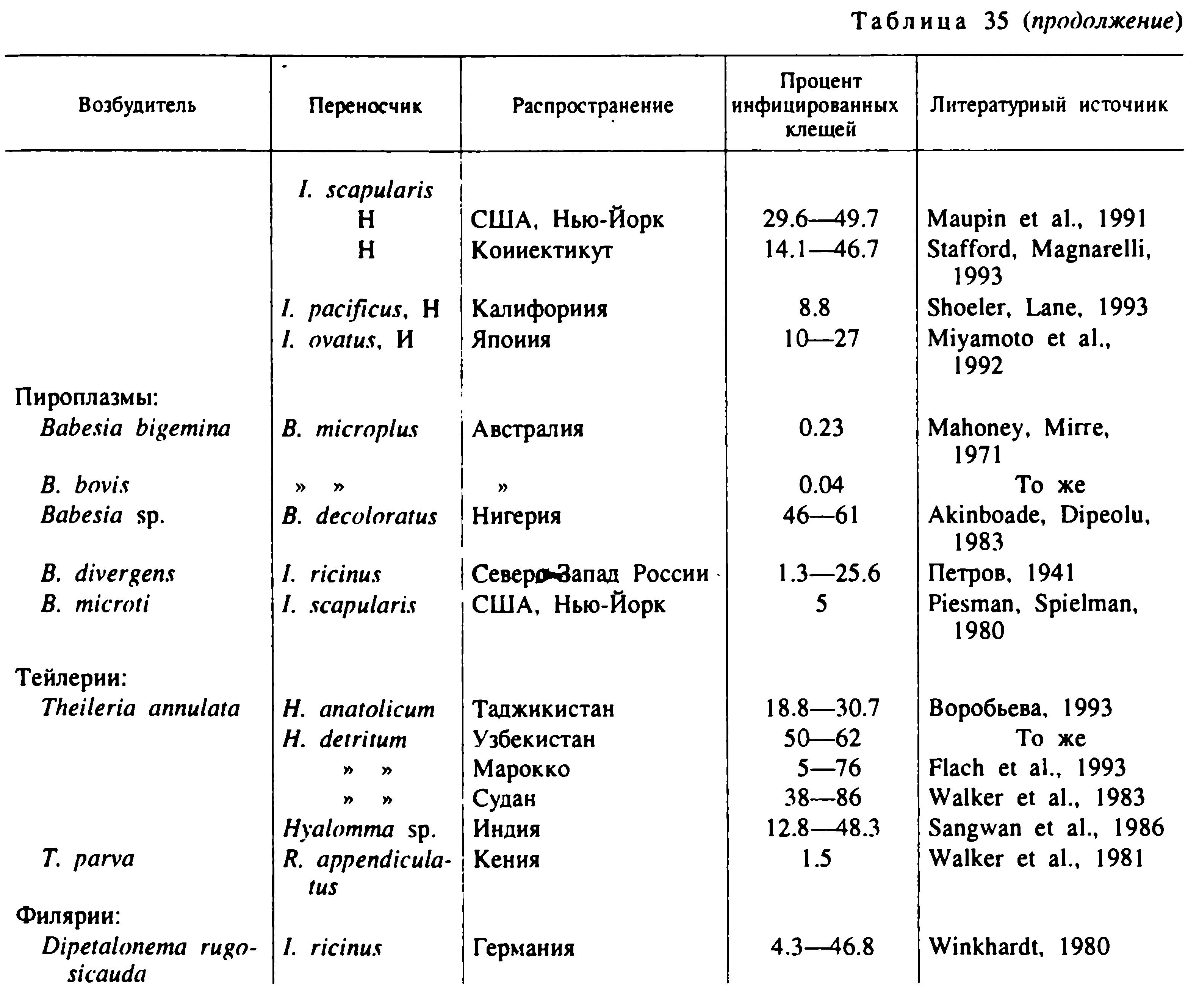
Годовые и сезонные колебания инфицированности клещей внутри одних и тех же природных очагов относительно невелики (не более 1.5—2 раз). Значительно больше различия в инфицированности клещей, принадлежащих к разным природным очагам в границах обширнейшего ареала инфекции (табл. 35). Предполагают (Korenberg, 1994), что среди населения России ежегодно случается более 12 000 новых заболеваний Лайм-боррелиозом.
Клещевой энцефалит в своем распространении связан и в значительной степени совпадает с видовыми ареалами главных переносчиков I. ricinus и I. persulcatus. Соответственно вирус клещевого энцефалита встречается на обширнейшей территории от Атлантического до Тихого океанов в разных типах лесных экосистем (Коренберг. Ковалевский, 1981). При разнообразии штаммов вируса большая часть их относится к одной из двух антигенно родственных групп — центральноевропейскому энцефалиту. Первый штамм связан преимущественно с I. ricinus и второй — с I. persulcatus. Дополнительными переносчиками могут быть I. pavlovskyi, I. hexagonus, H. concinna, H. japonica, D. silvarum и некоторые другие виды (Korenberg, Kovalevskii, 1994; Nuttall, Labuda, 1994).
В природных очагах вирус циркулирует между клещами и восприимчивыми видами мелких млекопитающих, главным образом из числа грызунов (Наумов и др., 1984). Например, в Западной Словакии при преимущественном питании личинок и нимф I. ricinus на мышевидных грызунах, по данным серологических исследований, серопозитивными к вирусу клещевого энцефалита в летние месяцы были до 47.7 % Apodemus flavicollis и 36.8 % Clethrionomys glareolus. Среднегодовые показатели для этих же видов за несколько лет составляли соответственно от 9.1 до 19.6 % для первого вида и от 10.8 до 20.8 % — для второго (Labuda et al., 1991).
По данным 7-летних наблюдений над очагом клещевого энцефалита на юге Кемеровской области, среди хозяев I. persulcatus серопозитивными к вирусу в летние месяцы были до 37.4 % Microtus oeconomus, 32.5 % — С. rufocanus и 23.9 % — М. agrestis, причем в разные годы эти показатели варьировали в 15 раз (Окулова, 1986). Взгляды на роль в циркуляции вируса в природе крупных млекопитающих (Наумов и др., 1983; Korenberg, Kovalevskii, 1994) и птиц, особенно в связи с их миграциями (Львов, Ильичев, 1979; Nuttall, Labuda, 1994), неоднозначны и требуются дальнейшие исследования.
Внутри очага, благодаря восприимчивости к вирусу многих видов млекопитающих и существованию нескольких возможных путей получения и передачи возбудителя клещами, имеется несколько дублирующих путей циркуляции и репродукции вируса. Несомненно, что клещи инфицируются при питании на животных с надпороговыми уровнями виремии в крови. В последнее время установлена возможность заражения клещей вирусом клещевого энцефалита и при отсутствии виремии в крови, когда одновременно питаются свободные от возбудителя и инфицированные особи клещей (Алексеев, Чунихин, 1990; Labuda et al., 1993a, 1993с). В этом случае мы имеем опосредованную через организм хозяина горизонтальную передачу вируса от клеща к хозяину. При агрегированном распределении питающихся клещей в популяции хозяина этот механизм по своей эффективности может не уступать инфицированию клещей на животных с высокой виремией крови. Достаточно эффективным может быть и половой путь передачи вирусов от самцов к самкам во время спаривания, в результате которого экспериментально может быть заражено до 50 % самок I. persulcatus (Чунихин и др., 1983). Вертикальная передача вируса от зараженных самок через яйца личинкам менее эффективна и обеспечивает инфицирование не более 1 % потомства I. ricinus (Danielova, Holubova, 1991).
Позвоночные получают вирус почти исключительно трансмиссивно при питании клещей, хотя в редких случаях возможно алиментарное заражение через молоко инфицированных животных, а также респираторное и контаминативное заражение фекалиями клещей.
Несомненно, что для вируса клещевого энцефалита клещи являются как переносчиками, так и резервуарами вируса, особенно при его перезимовке в этих членистоногих. В голодных самках I. ricinus установлено сохранение вируса при температуре 4 °С не менее 9 мес (Benda, 1958), а в напитавшихся личинках во время их зимовки в природе — 102 сут (Rehacek, 1960). На протяжении их развития наблюдаются как частичная потеря возбудителя при трансфазовой передаче, так и его амплификация, но количественные данные об этих процессах в значительной степени фрагментарны. Равным образом нет данных о том, какая часть вируса в очаге находится в клещах, а какая в позвоночных.
Несмотря на потенциальную возможность инфицирования и реинфицирования, практически на всех фазах развития реальная зараженность главных переносчиков в очагах инфекции сравнительно низкая и варьирует от долей до нескольких процентов. Только в отдельных районах Дальнего Востока, Сибири и Урала она достигает 10—15 % (табл. 35). В целом инфицированность I. ricinus обычно значительно ниже, чем I. persulcatus, а для каждого из этих видов наблюдаются значительные различия в зависимости от местоположения очага и конкретных условий циркуляции в них возбудителя. При многолетних наблюдениях над одними и теми же очагами обнаружены значительные годовые различия в зараженности клещей. Например, на юге Кемеровской области инфицированность клещей в разные годы варьировала в 5 раз (Окулова, 1986). В таежных лесах Хабаровского края при средней инфицированности I. persulcatus в 6.6 % в разные годы этот показатель варьировал от 3.4 до 9.4 % (Korenberg et al., 1992). Еще более значительные различия отмечены в содержании вируса в разных особях одной популяции. При этом было обнаружено, что заболеваемость населения клещевым энцефалитом в большей степени зависела от доли в популяции клещей с высоким содержанием вируса в организме, а не от общего числа инфицированных клещей (Korenberg, Kovalevskii, 1995). Ежегодная заболеваемость клещевым энцефалитом на территории бывшего СССР составила с 1987 по 1991 г. в среднем 4400 случаев за год, из которых 94 % приходились на долю России (Korenberg, 1994).
Геморрагическая лихорадка Крым-Конго спорадически встречается во многих странах юга Европы, Азии и в Африке. На территории бывшего СССР это заболевание обнаружено в Астраханской и Ростовской областях России, в Крыму, Молдавии, Казахстане и государствах Средней Азии. Заражение человека происходит через укус клеща, но возможно и при контакте больных лиц со здоровыми. Вирус был выделен от 31 вида иксодовых клещей, включая 12 видов Hyalomma, 8 — Rhipicephalus, 2 — Dermacentor. Природными резервуарами вируса могут быть многие виды мелких, средних, а в Африке и крупных млекопитающих. Резервуарами инфекции могут быть и некоторые виды птиц. В природных очагах геморрагической лихорадки Крым-Конго клещи служат не только переносчиками, но и резервуарами вируса. При отсутствии позвоночных-амплификаторов вирус длительное время сохраняется в популяции клещей благодаря его способности к трансстадиальной и в меньшей степени — к трансовариальной передаче. Дополнительными путями распространения вируса может быть инфицирование при совместном питании зараженных и «чистых» клещей, а также способность самцов к половой передаче вируса при копуляции (Linthicum, Bailey, 1994).
В России, Крыму и Молдавии главным переносчиком вируса служит клещ Н. marginatum, а в Средней Азии — Н. anatolicwn и Н. detritum. Дополнительными переносчиками могут служить R. rossicus, H. asiaticum, D. marginatus. Природными резервуарами инфекции служат заяц-русак, малый суслик, ежи и некоторые виды птиц (Львов, Ильичев, 1979; Чумаков, 1979).
Клещевыми риккетсиозами называют группу природно-очаговых инфекций человека, возбудителями которых служат риккетсии. Для этих микроорганизмов иксодовые клещи служат не только переносчиками, но и природными резервуарами. Последнее достигается благодаря исключительной способности этих возбудителей к пожизненному носительству, а также трансфазовой и трансовариальной передаче. В природе риккетсии циркулируют между многими видами клещей, диких млекопитающих и птиц. Заражение человека происходит через укус клеща и реже при контаминации раздавленными клещами слизистых оболочек или ранок на коже. На территории России известны 4 клещевых риккетсиоза (Балашов, Дайтер, 1973).
Клещевой сыпной тиф Северной Азии (возбудитель Rickettsia sibirica) встречается в лесостепных, степных, пустынных и реже лесных ландшафтах России от Урала до Дальнего Востока, а также в государствах Средней Азии, Казахстане, Монголии и Китае. Главными переносчиками служат, в зависимости от региона, клещи D. nuttalli, D. silvarum, D. marinatus, H. marginatum, H. asiaticum, H. japonica. Резервуарными хозяевами зарегистрированы 30 видов мелких и средних млекопитающих и несколько видов птиц. В странах Центральной Европы, Литве и Армении обнаружена близкая форма возбудителя — R. slovaca, главным переносчиком которой служит D. marginatus, а резервуарами — многие виды мелких млекопитающих.
Марсельская лихорадка (возбудитель R. conori) распространена в Африке, странах Средиземноморья, а в России на Черноморском и Каспийском побережьях Кавказа. Главным переносчиком повсеместно служит R. sanguineus, обитающий вблизи и даже внутри человеческого жилья. Резервуарами возбудителя могут быть многие виды мелких млекопитающих, а также собаки.
Лихорадка Ку (возбудитель Coxiella burnetii) наряду с природными формирует и антропургические очаги. Заболевание имеет всесветное распространение. В России лихорадка Ку встречается главным образом в степных и пустынных ландшафтах, но отдельные очаги были обнаружены в лесной зоне. Возбудитель был выявлен от 96 видов млекопитающих и 60 видов птиц, а также от многих видов сельскохозяйственных животных. Носителями возбудителя зарегистрировано свыше 70 видов иксодид и в их числе на территории бывшего СССР — 32 вида. Наряду с трансмиссивной передачей, благодаря исключительной выживаемости возбудителя во внешней среде, он передается аспираторным и контактным путями (с загрязненными сухими фекалиями клещей, шерстью и кожей животных), а также алиментарным путем с продуктами животноводства.
Туляремия (возбудитель Francisella tularensis) распространена во многих странах Европы, Азии, Африки и Северной Америки. Очень широкое распространение она имеет в России. Заболевание регистрируется от западной границы до Дальнего Востока и встречается в тундре, лесах, степях и пустыне. Туляремийный микроб выделен от 82 видов диких животных, крупного и мелкого рогатого скота, собак. Главными резервуарами служат водяная и обыкновенная полевки, домовые мыши, ондатры, зайцы и лемминги. Для туляремийного микроба известно множество путей передачи, одним из которых служит трансмиссивная передача при питании иксодовых клещей. Возбудитель выделен из многих видов клещей. Иксодовые клещи считаются наиболее эффективными переносчиками и хранителями туляремийного микроба в природных очагах. Переносчиками служат клещи D. reticulatus, D. marginatus, I. apronophorus, I. laguri, I. ricinus, R. rossicus (Олсуфьев, Дунаева, 1970).
Чума (возбудитель Yersinia pestis) принадлежит к природно-очаговым инфекциям, в распространении которых иксодовые клещи, по-видимому, играют второстепенную роль по сравнению с блохами. Для нескольких видов иксодид доказано спонтанное носительство чумного микроба и его длительное переживание в организме. В то же время прямые доказательства способности клещей к передаче чумного микроба трансмиссивным путем недостаточны (Кондрашкина и др., 1964).
Заболевания сельскохозяйственных животных. Для многих «клещевых инфекций» сельскохозяйственных животных в связи с исчезновением или редкостью диких резервуарных хозяев характерна большая простота эпизоотического процесса: циркуляция возбудителей ограничивается клещами и сельскохозяйственными животными. Ввиду практически всесветного распространения скота, лошадей и других домашних животных, существование подобных инфекций определяется в первую очередь географическими ареалами их клещей-переносчиков. Бабезиозы могут поддерживаться лишь при условии непрерывной циркуляции возбудителей между скотом и клещами. Трансовариальная передача бабезий исключительно важна, так как только инвазированные голодные личинки однохозяинных видов Boophilus могут обеспечить заражение новых хозяев-переносчиков. В дальнейшем эти же, зараженные во время личиночного и нимфального питания особи, обеспечивают реинфицирование бабезиями питающихся самок и новый цикл развития возбудителя. В отсутствии крупного рогатого скота клещи, несмотря на трансовариальную передачу бабезий, не могут обеспечить сохранение возбудителя на протяжении нескольких поколений (Friedhoff, Smith, 1981).
В европейской части России достаточно широко распространен бабезиоз крупного скота, вызываемый Babesia divergens и передаваемый клещом I. ricinus. На Северном Кавказе, а также в Закавказье и Средней Азии в местообитаниях В. апnulatus возбудителем бабезиоза крупного рогатого скота служит В. bovis. В тропических и субтропических регионах В. bovis вместе с В. bigemina повсеместно передается клещом В. microplus. Очень широко распространены в России и многих странах мира бабезиозы коз и овец (возбудители В. ovis и В. motasi), основными переносчиками которых служит R. bursa и другие виды родов Rhipicephalus и Haemaphysalis. Возбудитель бабезиоза лошадей В. caballi имеет всесветное распространение и передается многими видам Dermacentor, Hyalomma и Rhipicephalus. Часто встречается бабезиоз собак, вызываемый В. canis и передаваемый клещом R. sanguineus, а также видами Dermacentor.
Близки к описанным и эпизоотические особенности тейлериозов. В странах Средиземноморья, на Северном Кавказе, Закавказье и в Средней Азии тейлериоз крупного рогатого скота вызывает Theileria annulata. Ее переносчиками служат виды Hyalomma и в первую очередь Н. detritum и Н. anatolicum. В Приморском крае и странах Дальнего Востока возбудителем тейлериоза служит Т. sergenti и переносчиками — виды Haemaphysalis. Всесветное распространение имеет тейлериоз лошадей, возбудитель которого Т. (Nuttallia) equi передается видами Dermacentor, Hyalomma, Rhipicephalus.
В тропической Африке в крупном рогатом скоте паразитирует 6 видов тейлерий (Т. parva, Т. annulata, Т. mutans, Т. taurotragi, Т. velifera, Т. buffell), из которых 5 могут встречаться на одной территории и вызывать смешанные инфекции. В то же время тейлерий отличаются большей специфичностью к клещам-переносчикам. Т. annulata связана с несколькими видами рода Hyalomma, Т. mutans и Т. velifera — с видами рода Amblyomma, a T. parva — возбудитель лихорадки Восточного Берега — передается главным образом R. appendiculatus. Все эти виды клещей отличаются треххозяинным развитием, но питаются на скоте не только на имагинальной, но и на преимагинальных фазах. Последнее является исключительно важным, так как у тейлерий нет трансовариальной передачи. Клещи заражаются во время личиночного или нимфального питания, а передают возбудителей во время нимфального или имагинального. Совместное питание особей разных фаз развития облегчает инфицирование клещей, удлиняет сезон передачи и ускоряет циркуляцию тейлерий в очаге. В ЮАР, где из-за прохладной и сухой зимы у R. appendiculatus развивается диапауза, совместное питание особей разных фаз развития становится редким. В результате сезон передачи ограничен несколькими зимними месяцами, когда питаются взрослые особи (Young et al., 1992).
Ситуация с Т. parva усложняется существованием второго цикла циркуляции с дикими африканскими буйволами (Bubalus caffer) в качестве хозяев. Штаммы тейлерий из буйволов и крупного рогатого скота отличаются по своей вирулентности. Однако наличие общего переносчика R. appendiculatus создает возможность передачи штамма буйвола скоту. В результате большая часть инфицированных животных погибает. Тем не менее в выживших особях происходит ослабление вирулентности исходного штамма и он приобретает способность к циркуляции среди крупного рогатого скота (Norval et al., 1991a).
Зараженность клещей тейлериями обычно не превышает нескольких процентов и только у видов Hyalomma, пораженных Т. annulata, может достигать 50 % и более (табл. 35). Значительные различия в инфицированности переносчиков зависят от многих факторов, и в том числе от особенностей взаимоотношений возбудителей с клещами. В частности, Уолкер (Walker, 1990) считает, что в организме клещей происходит значительная гибель тейлерий на разных стадиях их развития в переносчике. Большая часть тейлерий гибнет еще в полости кишечника клеща, и лишь ничтожная часть из них достигает слюнных желез и превращается в спорозоитов. Часть паразитов гибнет уже в слюнных железах на стадии линьки после питания клещей на невосприимчивых хозяевах. Значительная часть паразитов погибает вместе с голодными клещами, нимфами и взрослыми, не сумевшими найти хозяина. При этом гибель голодных клещей от истощения выше среди инфицированных особей. В результате взаимодействия этих и других лимитирующих факторов инфицированность R. appendiculatus тейлериями в природе обычно не более 1—2 %.
Иксодовые клещи служат переносчиками патогенных для сельскохозяйственных животных риккетсий, включая возбудителя водянки сердца (Cowdria ruminantium) — эндемичного для Африки опасного заболевания крупного рогатого скота. Из инфекций с всесветным распространением в России встречаются анаплазмозы крупного и мелкого рогатого скота (возбудители Anaplasma marginale и A. ovis). Переносчиками их в России служат В. annulatus, I. ricinus и многие виды Нуаlomma, Dermacentor, Rhipicephalus, Haemaphysalis (Абрамов и др., 1965). В Европе и Северной Америке установлена передача клещами нескольких видов эрлихий (Ehrlichia), патогенных для крупного и мелкого рогатого скота, лошадей и собак. В последние годы доказана возможность заражения эрлихиями и человека (Walker, Dumler, 1996).